
【题目】近期埃博拉病毒在非洲各国肆虐,严重威胁了非洲人民的生命。在此期间,环境消毒是极其关键的,常常喷洒一种名为“84”的消毒液,其有效成分为NaClO。下列有关“84”消毒液的说法正确的是
A. “84”的消毒液属于纯净物
B. “84”的消毒液除能杀菌消毒外,还可作漂白剂
C. “84”消毒液中的NaClO比较稳定,不需密封保存
D. “84”消毒液杀菌消毒过程中并未发生氧化还原反应
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O![]() +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=________。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)大气污染物成分中属于酸性氧化物的是_______________________(填化学式)。
(2)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3。已知H2SO3是二元弱酸,写出反应的离子方程式:
①NaOH溶液吸收过量的SO2:_____________________________________________。
②氨水吸收过量的SO2:___________________________________________________。
(3)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2
2CO2+N2
①该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式)。
②当生成2mol N2时,转移电子的物质的量是___________________________。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,生成的产物都无毒。NH3还原NO2时,还原剂和氧化剂的物质的量之比是________________。
(5)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是____。
(6)SO2通过下列过程既能制得H2SO4又能制得H2。

①可循环利用的物质X是_________________(填化学式)。
②制得H2SO4的化学方程式是____________________________________。
③制得H2的化学方程式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
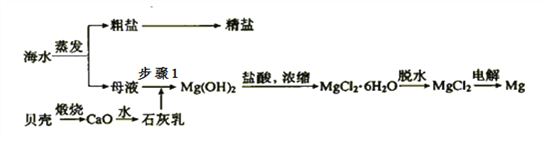
Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是 ______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Na2CO3溶液
加入试剂的顺序是_____________;
II.实验室利用精盐配制480mL 2.0mol·L1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是(_________)
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·xH2O。又知草酸(H2C2O4)分解的化学方程式为H2C2O4![]() CO↑+CO2↑+H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。
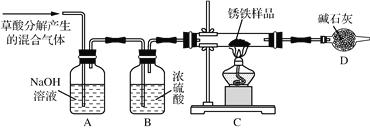
主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
①装置A的作用是__________________,装置B的作用是__________________。
②根据以上数据能否测定出锈铁的组成?答:________(填“能”或“不能”)。
③该装置还存在的一个明显的缺陷是______________________。
(2)乙同学在甲同学装置的基础上,将装置D换成装浓硫酸的洗气瓶装置E(此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,求:x 以及m(Fe)∶m(Fe2O3·xH2O) 的比值。(写出计算过程)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中混有的杂质,选择试剂及操作都正确的一项是( )
选项 | 物质 | 杂质 | 选择试剂 | 实验操作 |
A | Al2O3 | SiO2 | NaOH溶液 | 过滤 |
B | FeCl2 | FeCl3 | Fe粉 | 过滤 |
C | CO2 | SO2 | 澄清石灰水 | 洗气 |
D | I2 | NaCl | 酒精 | 萃取、分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Na2CO3、NaHCO3和NaCl的固体混合物100g。
(1)将该混合物加热到质量不再减少为止,反应方程式为:____________________,剩下的残渣为93.8g;该混合物中有___________g NaHCO3;
(2)将所有残渣放入烧杯中,加蒸馏水溶解后,配成500mL一定物质的量浓度溶液,配制过程中必需使用的化学仪器有__________(填选项的字母)。
A.烧杯 B.500 mL容量瓶 C.漏斗 D.胶头滴管 E.玻璃棒 F.量筒
(3)量取配制好的溶液50mL,向其中加入过量盐酸至不再产生气泡,共收集到1.12L气体(标准状况)。该反应过程的离子方程式为______________;则该混合物中有_________g NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列说法正确的是( )

A. a、d两点的溶液中Ba2+均恰好沉淀完全
B. b点的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C. d点溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
D. 溶液中由水电离的c(OH-)大小关系:a=d>c>b滴入溶液的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com