
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、 B、D、E金属性由强到弱的顺序为( )
A、D﹥A﹥B﹥E B、D﹥E﹥A﹥B
C、A﹥B﹥D﹥E D、A﹥B﹥E﹥D
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:单选题
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”获得2011年诺贝尔化学奖。某准晶体由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投人烧杯②中,注入稀硫酸浸没固体。下列分析合理的是
| A.在烧杯①中,若构成微型电池,负极反应式为2H2O十2e-=2OH-+H2↑ |
| B.在烧杯②中,若铁、铜构成微型电池,则铜为负极 |
| C.在烧杯①中,若构成微型电池,铝为负极 |
| D.在烧杯②中,向溶液中滴加KSCN溶液,溶液一定变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
| A.A为电源正极 |
| B.阳极反应式为:2H2O-4e-=4H++O2↑ |
| C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克 |
| D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是( )
| A.由TiO2制得1mol 金属Ti ,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为:C + 2O2-? 4e- ="=" CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极(已知铅蓄电池放电时的总反应为Pb + PbO2 + 2H2SO4= 2PbSO4 + 2H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
电化学在日常生活中用途广泛,图①是镁一次氯酸钠燃料电池,电池总反应为:
Mg+ClO—+H2O= Cl—+ Mg(OH)2↓,图②是Cr2O2—7的工业废水的处理。下列说法正确的是
| A.图②中Cr2O2—7离子向惰性电极移动,与该极附近的OH—结合转化成Cr(OH)3除去 |
| B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 |
| C.图①中发生的还原反应是:Mg2++ClO—+ H2O+ 2e—=Cl—+ Mg(OH)2↓ |
| D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2  2Li0.85NiO2,下列说法不正确的是( )
2Li0.85NiO2,下列说法不正确的是( )
| A.放电时,负极的电极反应式:Li-e-=Li+ |
| B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C.该电池既能用酸溶液又能用碱溶液作电解质溶液。 |
| D.放电过程中Li+向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下列各装置图的叙述中,正确的是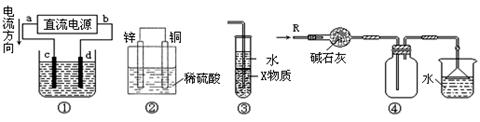
| A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于原电池的叙述正确的是 ( )
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池是将化学能转化为电能的装置 |
| C.在原电池中,电子流出的一极是负极,该电极被还原 |
| D.原电池放电时,电流的方向是从负极到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:
2Al+3 AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是 ( )
| A.当电极上析出0.54 g Ag时,电路中转移的电子为0.01 mol |
B.该隔膜是阳离子交换膜 |
| C.Al电极的反应式为:Al-3e-+3OH-=Al(OH)3 |
| D.正极的电极反应式为:AgO+2e-+2H+=Ag+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com