

 O2(g)=H2O(l)△H=-285.8kJ?mol-1;
O2(g)=H2O(l)△H=-285.8kJ?mol-1;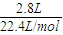 =0.125mol;正极反应为:3O2+12H2O+12e-=12OH-,计算得到电子转移为0.5mol;电解氯化钠溶液阴极电极反应为:2H++2e-=H2↑,根据水电离出的氢氧根离子和氢离子守恒,溶液中减少的氢离子和增加的氢氧根离子相同,计算得到生成氢氧根离子物质的量为0.5mol,C(OH-)=
=0.125mol;正极反应为:3O2+12H2O+12e-=12OH-,计算得到电子转移为0.5mol;电解氯化钠溶液阴极电极反应为:2H++2e-=H2↑,根据水电离出的氢氧根离子和氢离子守恒,溶液中减少的氢离子和增加的氢氧根离子相同,计算得到生成氢氧根离子物质的量为0.5mol,C(OH-)=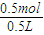 =1mol/L;所以溶液PH=14;电极上的电子守恒得到在Y极通过的电子的物质的量为0.5mol;
=1mol/L;所以溶液PH=14;电极上的电子守恒得到在Y极通过的电子的物质的量为0.5mol;

 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
 CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ?mol-1.它可以作为燃料电池的燃料.
CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ?mol-1.它可以作为燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源:山东省兖州市2010-2011学年高二上学期期末考试化学试题 题型:022
CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1.它可以作为燃料电池的燃料.
(1)写出甲烷燃烧的热化学方程式:________;
(2)已知H2(g)和C(S)的燃烧热分别是285.8 KJ·mol-1、393.5 KJ·mol-1;则反应C(s)+2H2(g)=CH4(g)的反应热ΔH=________;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池.该电池的负极反应式为:________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 ml滴有酚酞的NaCl溶液,装置如图所示:

①请写出电解过程中阴极附近观察到的现象:________.
②到燃料电池消耗2.8 L O2(标准状况下)时,计算此时NaCl溶液的pH=________(假设溶液的体积不变,气体全部从溶液中逸出).在Y极通过的电子的物质的量为:________.
③电解之后,要使溶液恢复原状,应该向溶液中加入物质________(填名称).
溶液中Cl―流向________极(填“X”或“Y”).
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省临夏河州中学高二(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com