


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
 如图是实验室制取氨气的气体发生装置,请
如图是实验室制取氨气的气体发生装置,请
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
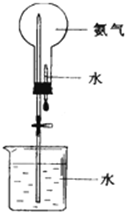 制取氨气并完成喷泉实验(图中夹持装置均已略去)
制取氨气并完成喷泉实验(图中夹持装置均已略去)
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
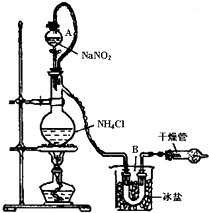 氯化铵是一种重要的化工原料,应用广泛.
氯化铵是一种重要的化工原料,应用广泛.
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).
| ||
| ||
| 你的判断 | NH2 | HCl |  |
| 能够制的 | a中药品: 浓氨水 浓氨水 b中药品: 氢氧化钠固体或氧化钙 氢氧化钠固体或氧化钙 |
a中药品: 浓盐酸 浓盐酸 b中药品: 浓硫酸 浓硫酸 | |
| 不能制的 | 原因: 无 无 |
原因: 无 无 |
| 1 |
| 22.4 |
| 1 |
| 22.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com