
A.凡是中心原子采取sp3杂化的 分子,其立体构形 分子,其立体构形 都是正四面体 都是正四面体 |
| B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 |
| D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
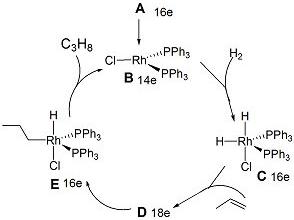
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
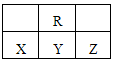
| A.R的气态氢化物比Y的气态氢化物稳定 |
| B.原子半径大小顺序是Z>Y>X |
| C.Y、R形成的化合物YR2能使KMnO4溶液褪色 |
| D.X、Y、Z中X的最高价氧化物对应的水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属性强弱: I>Br>Cl | B.原子半径大小:Na>P> S |
| C.碱性强弱:KOH>NaOH>LiOH | D.金属性强弱: Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (10分)X、Y、Z、W
(10分)X、Y、Z、W 是元素周期表前四周期中的四种常见元素,其相关信息如下表:
是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相 关 信 息 |
| X | X的基态原 子核外3个 子核外3个 能级上有电子,且每个能级上的电子数相等 能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
 Z的简单离子半径(选填“>”、“=”、“<”)。
Z的简单离子半径(选填“>”、“=”、“<”)。 。
。 色。反应过程中涉及的离子方程式为:
色。反应过程中涉及的离子方程式为:  、 。
、 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com