有X、Y、Z三种元素,其中Y、Z为短周期元素,;X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电子数相等;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol.在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色.试回答:
(1)元素符号:X ,Y ,Z .
(2)Y的两种氧化物为 和 .写出此两种氧化物与水反应的化学方程式 ; .
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,可发生反应,该反应的离子方程式为 .
(4)写出Y和Z形成的化合物的电子式: ;Z单质分子的电子式: .
【答案】
分析:X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同,X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色,则X为I;Z和X的原子最外层电子数相等,均为ⅤⅡA族元素,Z为短周期元素,且与碘离子发生氧化还原反应,则Z为Cl;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol,氧化物分别为Na
2O、Na
2O
2,则Y为Na,然后利用元素及其单质、化合物的性质来解答.
解答:解:X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同,X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色,则X为I;Z和X的原子最外层电子数相等,均为ⅤⅡA族元素,Z为短周期元素,且与碘离子发生氧化还原反应,则Z为Cl;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol,氧化物分别为Na
2O、Na
2O
2,则Y为Na,
(1)X为I,Y为Na,Z为Cl,故答案为:I;Na;Cl;
(2)Na的两种氧化物分别为Na
2O、Na
2O
2,分别与水反应的方程式为Na
2O+H
2O═2NaOH、2Na
2O
2+2H
2O═4NaOH+O
2↑,
故答案为:Na
2O;Na
2O
2;Na
2O+H
2O═2NaOH;2Na
2O
2+2H
2O═4NaOH+O
2↑;
(3)氯气与NaI溶液反应置换出单质碘,离子反应为Cl
2+2I
-═2Cl
-+I
2,故答案为:Cl
2+2I
-═2Cl
-+I
2;
(4)NaCl为离子化合物,电子式为
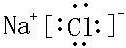
,氯气的电子式为
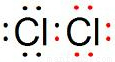
,
故答案为:
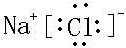
;
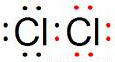
.
点评:本题考查原子结构与元素周期律,元素的推断较难,学生对第五周期的元素不熟悉,然后利用元素及其单质的性质即可解答.

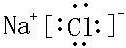 ,氯气的电子式为
,氯气的电子式为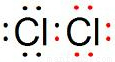 ,
,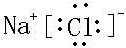 ;
;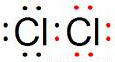 .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


