

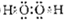 ,
,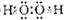 ;
;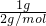 =0.5mol,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ,
=0.5mol,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ, O2(g)=H2O(l)△H=-285.8kJ/mol,
O2(g)=H2O(l)△H=-285.8kJ/mol, O2(g)=H2O(l)△H=-285.8kJ/mol;
O2(g)=H2O(l)△H=-285.8kJ/mol; 4Al+3O2↑,
4Al+3O2↑, 4Al+3O2↑.
4Al+3O2↑.

科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中,与D形成的化合物是生活中最常用的调味品 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com