
分析 根据金属晶体是由金属阳离子和自由电子构成的;离子晶体是阴阳离子通过离子键结合而成的;分子晶体是由分子通过分子间作用力结合而成的;原子晶体是由原子通过共价键以空间网状结构形成的,据此分析.
解答 解:金属晶体是由金属阳离子和自由电子构成的,属于金属晶体的是②⑦;
原子晶体是由原子通过共价键以空间网状结构形成的,属于原子晶体的是①④;
离子晶体是阴阳离子通过离子键结合而成的,属于离子晶体的是③⑥;
分子晶体是由分子通过分子间作用力结合而成的,属于分子晶体的是⑤⑧;
故答案为:②⑦;①④;③⑥;⑤⑧.
点评 本题主要考查了晶体类型的判断,掌握常见晶体的粒子构成是正确解答本题的关键,难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:选择题
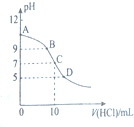 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | B、D两点溶液中水电离出来的c(OH-):B<0 | |
| D. | C点溶液中的H2O不发生电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | HE3中H与E之间以离子键结合 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
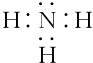 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 由共价键形成的物质一定是共价化合物 | |
| D. | 非金属原子间形成的化学键一定是共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com