


科目:高中化学 来源: 题型:
+ 4 |
+ 4 |
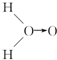 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《物质结构与性质》模块选择题
1.下列性质不能用金属键理论解释的是
A.导电性 B.导热性 C.延展性 D.锈蚀性
2.下列说法错误的是
A.O3与SO2的结构与性质相似
B.硫粉不溶于水,易溶于CS2中
C.Be(OH)2是两性氢氧化物
D.在相同条件下, 的沸点高于
的沸点高于![]()
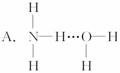
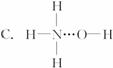
3.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,根据氨水的性质可推知NH3·H2O的结构式为


《有机化学基础》模块选择题
4.已知某有机物A的分子式C2H6O的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
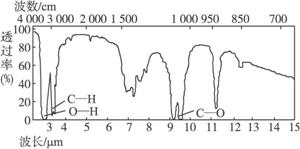
未知物A的红外光谱
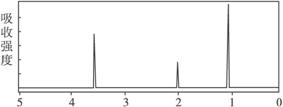
未知物A的核磁共振氢谱
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C.仅由其核磁共振氢谱可知其分子中的各类型氢原子总数
D.则A的结构简式为CH3—O—CH3
5.在阿司匹林的结构简式(下式)中①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共煮时,发生反应时断键的位置是
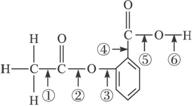
A.①④ B.②⑤ C.③④ D.②⑥
6.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如下式,下列有关该物质的说法正确的是
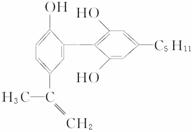
A.该分子中所有碳原子可以稳定地共存在一个平面中
B.1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。

(1)写出下列各反应阶段所发生的离子反应式:
①写出O-A段发生的离子反应式: 。
②A-B段发生的离子反应式: 。
③B-C段发生的离子反应式: 。
(2)分析A点溶液中主要存在那些离子: 。
(3)求原溶液中硫酸浓度是: 和硝酸的浓度是: 。
查看答案和解析>>
科目:高中化学 来源:2011届浙江省杭十四中高三上学期11月月考化学卷 题型:填空题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
(1)写出下列各反应阶段所发生的离子反应式:
①写出O-A段发生的离子反应式: 。
②A-B段发生的离 子反应式: 。
子反应式: 。
③B-C段发生的离子反应式: 。
(2)分析A点溶液中主要存在那些离子: 。
(3)求原溶液中硫酸浓度是: 和硝酸的浓度是: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。

(1)写出下列各反应阶段所发生的离子反应式:
①写出O-A段发生的离子反应式: 。
②A-B段发生的离子反应式: 。
③B-C段发生的离子反应式: 。
(2)分析A点溶液中主要存在那些离子: 。
(3)求原溶液中硫酸浓度是: 和硝酸的浓度是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com