


科目:高中化学 来源: 题型:
①把贝壳制成石灰乳 ②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤、干燥产物 ④将得到的产物熔融后电解
关于从海水中提取镁的下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解制镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(10分)(1)写出下列工业生产过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________________
②电解法冶炼铝______________________________________________________
③湿法炼铜______________________________________________________
(2)海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下步骤:
①把贝壳制成石灰乳
②直接往海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解。
下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)海水是镁的重要来源,从海水中提镁须经过以下流程:
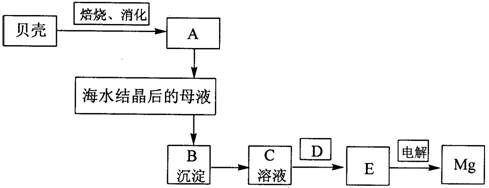
3-1分别写出A、B、C、D、E是什么物质。
3-2回答为什么不选择电解MgO制备金属镁。
3-3用电解法制备碱金属、碱土金属时,常常加入CaC12,为什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com