
常温常压下过氧化钠可与CO2反应,与CO不反应。现将CO2、CO的混合气体在一定条件下和足量过氧化钠充分反应后,若固体质量增加了28 g,下列说法正确的是( )
A.反应过程中,电子转移数为2NA
B.固体生成物的质量为106 g
C.CO可能有剩余
D.反应后一定生成11.2 L氧气
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
ClO2是一种杀菌消毒效率高的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是( )
A.ClO2是还原产物
B.1 mol KClO3参加反应,失去电子为1 mol
C.H2C2O4在反应中被氧化
D.H2C2O4的还原性大于ClO2的还原性
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:填空题
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
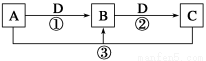
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是____________________;工业上制取A的离子方程式为______________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是____________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为____________________。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:_______________
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是( )
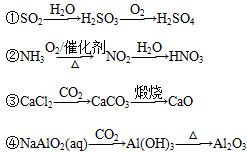
A.②③ B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十七有机化学基础练习卷(解析版) 题型:填空题
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
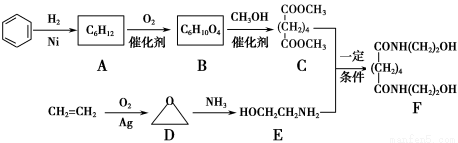
(1)B的结构简式是____________;E中含有的官能团名称是________。
(2)由C和E合成F的化学方程式是___________________________________________
(3)同时满足下列条件的苯的同分异构体的结构简式是________________。
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰 ③不存在甲基
(4)乙烯在实验室可由______(填有机物名称)通过________(填反应类型)制备。
(5)下列说法正确的是________(填字母序号)。
a.A属于饱和烃 b.D与乙醛的分子式相同 c.E不能与盐酸反应 d.F可以发生酯化反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| FeCl2 | FeCl3 | Fe | CuCl2 |
② | NO | NO2 | N2 | HNO3 | |
③ | Na2O | Na2O2 | Na | NaOH | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①④ B.①②③ C.①③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)____________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)________________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A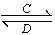 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________________________;由A转化为B的离子方程式为___________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:
________________________________________________________________________。
A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是____________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:
2SO2(g)+O2(g)  2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1 mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com