
| A. | 向10mL 0.1mol•L-1的NaHCO3溶液中滴加3mL0.2mol.L-1盐酸后所得溶液中:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中c(CH3COO-)+c(H+)<c(Na+)+c(OH-) | |
| D. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
分析 A、向10mL 0.1mol•L-1的NaHCO3溶液中滴加3mL0.2mol.L-1盐酸后所得溶液是碳酸氢钠和氯化钠的混合物,据物料守恒来回答;
B、20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL0.1 mol•L-1 HCl溶液混合所得溶液是等浓度的醋酸钠、氯化钠和醋酸的混合物;
C、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合得到的是醋酸和醋酸钠的混合物,据此回答;
D、硫酸铵中,铵根离子水解导致溶液显示酸性.
解答 解:A、向10mL 0.1mol•L-1的NaHCO3溶液中滴加3mL0.2mol.L-1盐酸后所得溶液是碳酸氢钠和氯化钠的混合物,只有碳酸氢钠就存在物料守恒:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3),但是溶液中还有氯化钠存在,故A错误;
B、20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL0.1 mol•L-1 HCl溶液混合所得溶液是等浓度的醋酸钠、氯化钠和醋酸的混合物,溶液显示酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,此时存在:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),故B正确;
C、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合得到的是醋酸和醋酸钠的混合物,显示酸性c(H+)>c(OH-),所以c(CH3COO-)>c(Na+),存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),即c(CH3COO-)+c(H+)>c(Na+)+c(OH-),故C错误;
D、硫酸铵中,铵根离子浓度是硫酸根离子浓度的2倍小一点,铵根离子水解导致溶液显示酸性c(H+)>c(OH-),即c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D错误.
故选B.
点评 本题考查了溶液中离子浓度的大小关系知识,题目难度中等,明确电荷守恒、盐的水解原理为解答关键,注意掌握电离平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁金属活泼性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | ①④⑤ | B. | ②③⑤ | C. | ①②③④⑤⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
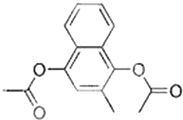 维生素K4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素K4说法正确的是( )
维生素K4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素K4说法正确的是( )| A. | ①②③ | B. | ③④⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
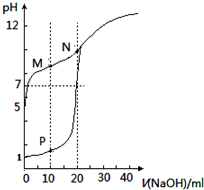
| A. | 滴定时均可用酚酞作指示剂 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液混合,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | 向N点的溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在电离只有HCO3-?H++CO32-,H2O?H++OH- | |
| B. | HCO3-的电离程度大于HCO3-的水解程度 | |
| C. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| D. | c (Na+)═c (HCO3-)+c (CO32-)+c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白纸浆和草帽辫 | B. | 用硫酸清洗锅炉中的水垢 | ||
| C. | 高温下用焦炭还原SiO2制取粗硅 | D. | 丁达尔效应可以区分溶液与胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com