
【题目】下列互为同位素的是
A. Na 和 Na+ B. H2和 D2 C. 16O 和 18O D. CO 和 CO2
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
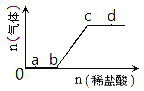
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
C. b点对应的溶液中:Al3+、Fe3+,MnO4-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月,科学家首次观测到化学键的形成。下列粒子之间存在化学键的是
A. 质子与电子之间 B. 水分子与水分子之间
C. 氧分子中氧原子与氧原子之间 D. 氯化钠中钠离子与钠离子之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(1)在K2MnO4溶液中通入CO2可制得高锰酸钾,副产物是黑色沉淀M。该反应中氧化剂与还原剂的质量之比为__________________。由锂离子有机高聚物、锂及M构成原电池,电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子。则该电池正极的电极反应为___________________________________。
(2)实验室用KMnO4制备O2和Cl2。取0.4mol KMnO4固体加热一段时间后,收集到
amolO2,在反应后的残留固体中加入足量浓盐酸,加热又收集到bmolCl2。设锰元素全部
转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为______L;
(3)电解K2MnO4溶液加以制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4 ,化学方程式为_______________________________。用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:

则D的化学式为___________;阳极的电极反应式为_____________________;阳离子迁移方向是___________________。
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42-)。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(-O-O-)。写出检验Mn2+的离子方程式_________________________________。如果将这个反应设计成盐桥原电池,盐桥中溶液最好选用______________。(选填:饱和KCl溶液、饱和K2SO4溶液或饱和NH4Cl溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如下图所示是中学化学中常用的混合物分离和提纯的装置。

请根据装置A、B、C、D、E回答下列问题:
(1)从硫酸钡和硫酸钠的混合液中分离出硫酸钡,可选择装置____(填字母,下同);
(2)从氯化钠(大量)和硝酸钾(少量)的混合溶液中分离出氯化钠(晶体)的方法是____,洗涤,干燥。整个过程选择装置_____;
(3)分离酒精和水,选择装置__________;
(4)装置A中①的名称是______,冷却水的流动方向是_______.
(5)从淀粉和氯化钠的混合液中分离出氯化钠,选择装置______ ;该实验称为____(填方法)。
(6)碘水中提取碘单质(固体)的方法是: 先用_____装置,可选用哪种萃取剂______(填代号)
然后用_______装置,分离出的碘单质(固体) 处于_______装置中(填名称)。
①酒精 ②苯 ③醋酸 ④汽油
(7)在用装置B进行操作时,为使液体顺利滴下,应进行的具体操作是_______。分液后漏斗内剩余的液体从分液漏斗的______(填“上口”或“下口”)倒入烧杯。
Ⅱ.用如图装置测定水中氢、氧元素的质量比,其方法是分别测定Ⅱ、Ⅲ中通氢气前后玻璃管的质量差(设为m) 和U型管的质量差(设为n),
(8) 计算m(H):m(O)=__________ (用含m、n的式子表示)
(9) 若实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是________

A.CuO没有全部被还原
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝
D.I、Ⅱ装置之间缺少干燥装置
E.U 型管中CaCl2失效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A. “对电极”是负极
B. “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O
C. 传感器工作时H+由工作电极移向对电极
D. 对电极的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用马矿的矿渣(成分Fe2O3FeOAl2O3SiO2)制备明矾[KAl(SO4)2·12H2O]和绿矾FeSO4·7H2O流程如下:

(1)操作I得到的滤渣主要成分是__________
(2)加入H2O2的离子反应方程式为__________
(3)若X是一种固体单质,且溶液Ⅲ的溶质只有一种,则X化学式为_________
(4)向明矾水溶液中加过量的NaOH溶液,其离子方程式为_________
(5)绿矾放置在空气中,可能被氧气氧化,请设计实验判断绿矾是否被氧化(简述实验过程现象和结论)____
(6)若实验室取用1kg矿渣(含铁元素5.6%)进行实验,操作Ⅱ中消耗铁红80g,假设每个过程反应都恰好完全进行,且忽略损失,则理论上得到绿矾__________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com