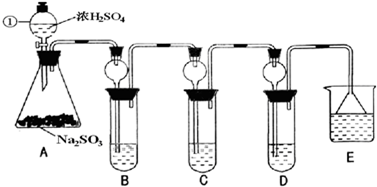
(2011?天津模拟)纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl
2溶液中通入NH
3和C0
2,可以制得纳米级碳酸钙.某校学生实验小组设计下图所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图1中夹持装置已略去.
Ⅰ.可选用的药品有:a.石灰石b.饱和氯化钙溶液c.6mol/L盐酸d.氯化铵e.氢氧化钙.

(1)A中制备气体时,所需药品是(选填字母序号)
ac;
ac;
;
(2)B中盛有饱和碳酸氢钠溶液,其作用是
除去二氧化碳中的氯化氢
除去二氧化碳中的氯化氢
;
(3)写出制取氨气的化学方程式
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O,
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O,
;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式
NH3
NH3
;
(5)检验D出口处是否有氨气逸出的方法是
用湿润的红色石蕊试纸放到D出口处,如果试纸变蓝,则氨气逸出,反之则不逸出,或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气则氨气逸出,反之则不逸出
用湿润的红色石蕊试纸放到D出口处,如果试纸变蓝,则氨气逸出,反之则不逸出,或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气则氨气逸出,反之则不逸出
;
(6)写出制纳米级碳酸钙的化学方程式
CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl
CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl
.
(7)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
将少量碳酸钙加水充分搅拌,用一束可见光照射,观察是否发生丁达尔现象,若有丁达尔现象则为纳米级,若没有丁达尔现象则不是纳米级;
将少量碳酸钙加水充分搅拌,用一束可见光照射,观察是否发生丁达尔现象,若有丁达尔现象则为纳米级,若没有丁达尔现象则不是纳米级;
.
(8)若实验过程中有氨气逸出,应选用图2中
b
b
装置回收(填代号).
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠.为了测定氯化铵的质量分数,该学生实验小组又设计了如图3所示实验流程:
试回答:
(1)所加试剂A的化学式为
Ca(OH)2或Ba(OH)2
Ca(OH)2或Ba(OH)2
检验所加试剂A已经过量的方法是
向澄清液中继续滴加氢氧化钡或氢氧化钙溶液,若不产生沉淀,则氢氧化钡或氢氧化钙溶液已过量
向澄清液中继续滴加氢氧化钡或氢氧化钙溶液,若不产生沉淀,则氢氧化钡或氢氧化钙溶液已过量
.
(2)B操作方法是
过滤
过滤
洗涤沉淀的方法是
向沉淀中继续加蒸馏水,静置流下,重复两次即可
向沉淀中继续加蒸馏水,静置流下,重复两次即可
.
(3)样品中氯化铵的质量分数为
.