
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________________________
(2)“矿渣”中除了S以外,还有____________(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是____________________________________
(3)“保温除铁”过程中,加入CuO的目的是____________________________________;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是____________
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________;向“滤液M”中加入(或通入) ____________(填母代号),可得到另一种流程中可循坏利用的物质。
a.铁 b.氯气 c.高锰酸钾![]()
【答案】 Cu2S+4Fe3+=2Cu2++4Fe2++S SiO2 温度过高苯易挥发,温度过低矿渣中硫的溶解速率或溶解度小 调节溶液的pH,促进Fe3+水解平衡正向移动,生成Fe(OH)3沉淀 抑制Cu2+的水解 4NOx+(5-2x)O2+2H2O=4HNO3 b
【解析】考查化学工艺流程,(1)Cu2S中Cu显+1价,S显-2价,都具有还原性,FeCl3中Fe3+具有强氧化性,根据流程,浸取发生的离子反应是Cu2S+4Fe3+=2Cu2++4Fe2++S;(2)根据辉铜矿的成分,含有少量的脉石,SiO2不与FeCl3发生反应,因此矿渣中还含有SiO2;苯的沸点较低,温度过高,苯易挥发,温度过低,反应速率慢或溶解度小;(3)置换过程过滤后,得到固体物质是Cu和Fe,Cu和Fe与硝酸反应生成Cu(NO3)2和Fe(NO3)3,Fe3+水解:Fe3++3H2O ![]() Fe(OH)3+3H+,加入CuO的目的是调节件pH,促使Fe3+水解,生成氢氧化铁沉淀;Cu(NO3)2溶液中Cu2+发生水解,Cu2++2H2O=Cu(OH)2+2H+,加入硝酸,抑制Cu2+水解;(4)氮的氧化物与氧气、H2O反应生成HNO3,硝酸是循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3;置换中发生Fe+CuCl2=FeCl2+Cu、Fe+2FeCl3=3FeCl2,滤液M中成分是FeCl2,根据流程图,FeCl3是循环物质,即需要加入Cl2,把FeCl2氧化成FeCl3,故选项B正确。
Fe(OH)3+3H+,加入CuO的目的是调节件pH,促使Fe3+水解,生成氢氧化铁沉淀;Cu(NO3)2溶液中Cu2+发生水解,Cu2++2H2O=Cu(OH)2+2H+,加入硝酸,抑制Cu2+水解;(4)氮的氧化物与氧气、H2O反应生成HNO3,硝酸是循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3;置换中发生Fe+CuCl2=FeCl2+Cu、Fe+2FeCl3=3FeCl2,滤液M中成分是FeCl2,根据流程图,FeCl3是循环物质,即需要加入Cl2,把FeCl2氧化成FeCl3,故选项B正确。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是________。
a. 用熟石灰处理废水中的酸
b. 用臭氧处理废水中的氰化物
c. 用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a. 作物秸杆露天焚烧
b. 废干电池就地填埋
c. 废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
①属于人体所需微量元素的是________。
②属于脂溶性维生素的是________。
③可为人体提供能量的是________、________和________。
(3)材料的发展与应用促进了人类社会的进步。
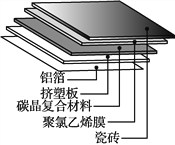
①碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是________;属于硅酸盐材料的是________;属于高分子材料的是挤塑板和________。
②吸附材料具有多孔、表面积大的特点。活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体。写出该反应的化学方程式:_________________________________________。
③LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是合成免疫抑制剂药物霉酚酸的中间体,可由如下路径合成得到. 
(1)有机物A中的含氧官能团的名称为 .
(2)由C转化为D的反应类型为 .
(3)反应⑦除了得到有机物H外还得到HBr,试剂X的结构简式为 .
(4)步骤⑤可得到副产品有机物J,有机物J和有机物F互为同分异构体,写出有机物J的结构简式:(任写一种).
(5)E的一种同分异构体满足下列条件: Ⅰ.可以发生银镜反应,且能够与NaHCO3反应产生CO2;
Ⅱ.是芳香族化合物,且核磁共振氢谱图显示分子中有4种不同化学环境的氢.
写出该同分异构体的结构简式: .
(6)已知:直接与苯环相连的卤素原子难以与NaOH水溶液发生取代反应.根据已有知识并结合相关信息,写出以 ![]() HCHO为原料制备
HCHO为原料制备 ![]() 合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH
合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH ![]() H2C=C2H
H2C=C2H ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种微粒。已知:
①当A微粒失去3个电子后,其电子层结构与氖原子相同;
②当B微粒得到1个电子后其电子层结构与氩原子相同;
③C微粒带两个单位正电荷,核电荷数为12;
④D微粒有18个电子,当失去2个电子后显电中性;
⑤E微粒不带电,原子核中只有一个质子。
请回答:
(1)写出这五种微粒的符号:A_______,B_______,C_______,D______,E_______。
(2)B微粒的结构示意图________,D微粒的结构示意图_________。
(3)A的单质与EB溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)十O2(g)=2SO3(g) △H =-198kJ·mol-1,在V2O3存在时,该反应机理为:V2O3+ SO2-→+2VO3+ SO3(快) 4VO2+O2→2 V2O3(慢)。下列说法正确的是
A. 反应速率主要取决于V2O3的质量 B. VO2是该反应的催化剂
C. 该反应逆反应的活化能大于198kJ/mol D. 升高温度,该反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论错误的是
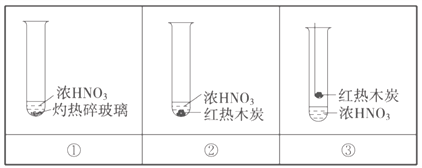
A. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
B. 由①中的红棕色气体,推断产生的气体一定是混合气体
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体的化学元素的叙述,正确的是( )
A. 组成生物体和组成无机自然界的化学元素中,碳元素的含量最多
B. 人、动物与植物所含的化学元素的种类差异很大
C. 组成生物体的化学元素在无机自然界都可以找到
D. 不同生物体内各种化学元素的含量比例基本相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是
A. ![]() 与
与![]() 得电子能力相同
得电子能力相同
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、 S2-、 Ca2+、 K+半径逐渐减小
D. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com