
下列离子方程式与所述事实相符且正确的是 ( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O === HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+2H++2Cl-  Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3 === 2FeO42-+3Cl-+H2O+4H+
科目:高中化学 来源: 题型:
有关物质燃烧时火焰颜色描述错误的是
A 氢气在氯气中燃烧-苍白色 B 钠在空气中燃烧——黄色
C 乙醇在空气中燃烧——淡蓝色 D 硫在氧气中燃烧——绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )。
A.一定被氧化
B.一定被还原
C.可能被氧化也可能被还原
D.以上都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:
2KClO3+4HCl (浓)==2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况(用双线桥法表示)。
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.1 mol Cl2,则转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
| Ⅰ | Ⅱ | |
| A | 将少量浓氨水滴入Al2(SO4)3溶液 | 将少量Al2(SO4)3溶液滴入浓氨水 |
| B | 将少量SO2通入Ba(OH)2溶液 | 将过量SO2通入少量Ba(OH)2溶液 |
| C | 将0.1mol Cl2通入含0.2molFeBr2的溶液中 | 将0.3mol Cl2通入含0.2mol FeBr2溶液 |
| D | 将过量BaCl2溶液与少量Na2SO4溶液相混合 | 将少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________。 在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是________________________。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
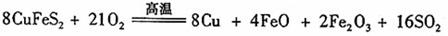
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于C、Si、S、Cl四种非金属元素的说法中,正确的是( )
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4 < SiH4 < H2S < HCl
D.最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________ 。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g)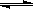 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是Ⅰ Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是Ⅰ Ⅱ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com