
 已知下列反应:
已知下列反应:| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
分析 (1)溶液呈蓝色的现象,必须铁离子过量,由①2Fe3++2I-?2Fe2++I2(s)(慢);②I2+2S2O32-═2I-+S4O62-(快),所以铁的物质的量大于S2O32-的物质的量;(2)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
②将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n得m和n的值;
③加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动;
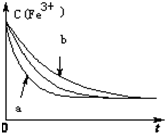
(3)①曲线a达平衡的时间缩短,改变的条件是:加入催化剂;
②曲线b达到平衡的时间增长,改变的条件是:降低反应温度;
(4)可使溶液颜色变浅的是平衡逆向移动,
A.加入少量KCl晶体,平衡不移动;
B.加入少量Na2SO3晶体与铁离子发生氧化还原反应,平衡逆向移动;
C.加入少量Na2CO3溶液,促进铁离子的水解,平衡逆向移动;
D.加入较浓的KSCN溶液,平衡正向移动;
(5)依据平衡常数的概念结合反应写出计算式计算平衡浓度得到.
解答 解:(1)溶液呈蓝色的现象,必须铁离子过量,由①2Fe3++2I-?2Fe2++I2(s)(慢);②I2+2S2O32-═2I-+S4O62-(快),所以铁的物质的量大于S2O32-的物质的量,所以n(S2O32-):n(Fe3+)<1,故答案为:<1;
(2)①该反应的平衡常数K的表达式为K=$\frac{{c}^{2}(F{e}^{2+})}{{c}^{2}({I}^{-}){c}^{2}(F{e}^{3+})}$,故答案为:K=$\frac{{c}^{2}(F{e}^{2+})}{{c}^{2}({I}^{-}){c}^{2}(F{e}^{3+})}$;
②将表中的三组数据代入公式kcm(I-)•cn(Fe3+)
得0.20m×0.80n=0.032,
0.60m×0.40n=0.144,
0.80m×0.20n=0.128,
解之得:m=2,n=1,
所以I-浓度对反应速率的影响大,故答案为:大于;
③加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动,
故答案为:向右;
(3)①曲线a达平衡的时间缩短,改变的条件是:加入催化剂,故答案为:加入催化剂;
②曲线b达到平衡的时间增长,改变的条件是:降低反应温度,故答案为:降低反应温度;
(4)A.加入少量KCl晶体,平衡不移动,颜色不变,故错误;
B.加入少量Na2SO3晶体与铁离子发生氧化还原反应,平衡逆向移动,颜色变浅,故正确;
C.加入少量Na2CO3溶液,促进铁离子的水解,平衡逆向移动,颜色变浅,故正确;
D.加入较浓的KSCN溶液,平衡正向移动,颜色加深,故错误;
故选:BC;
(5)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,反应Fe (OH)3+3H+?Fe3++H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{[\frac{1{0}^{-14}}{c(O{H}^{-})}]^{3}}$=c(Fe3+)×c3(OH-)×1042=2.79×10-39×1042=2.79×103,故答案为:2.79×103.
点评 本题考查探究化学反应速率的影响因素,明确反应的现象及控制变量法、影响反应速率及平衡的因素等即可解答,题目难度中等.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 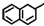 中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. | 丙烷中所有的原子均在一个平面 | |
| C. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) | |
| D. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
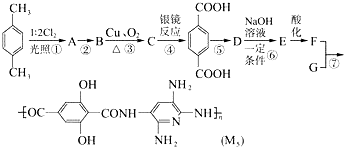
 ,F的含氧官能团的名称有羧基、(酚)羟基.
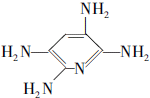
,F的含氧官能团的名称有羧基、(酚)羟基.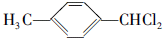 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
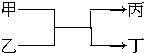 若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 碳和镁 | B. | 氟气和氧气 | C. | 碳和氢气 | D. | 氧气和硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | |
| B. | 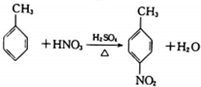 | |
| C. | 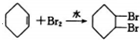 | |
| D. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com