
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
A.Al2O3、SO2、CO2、SO3 B.Cl2、Al2O3、N2O5、SO3
C.CO2、Cl2、CaO、SO3 D.SiO2、N2O5、CO、Cl2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述正确的是
H++CH3COO-,下列叙述正确的是
A.0.10mol/L醋酸溶液中粒子浓度的关系满足:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
B.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
C.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO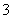 的物质的量浓度之比为1∶3,则此反应中被还原的氯元素与被氧化的氯元素原子的物质的量之比是(
的物质的量浓度之比为1∶3,则此反应中被还原的氯元素与被氧化的氯元素原子的物质的量之比是(
A.21∶5 B.11∶3
C.4∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
向25 mL 18.4 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )21教育名师原创作品
A.小于0.23 mol
B.等于0.23 mol
C.0.23 mol~0.46 mol之间
D.等于0.46 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1∶1∶1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1∶6 B.16∶25
C.2∶1 D.1∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L H2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是________________________________________________________________________,
乙的电子式是________________________________________________________________________。
(2)甲与水反应的化学方程式是________________________________________________________________________
________________________________________________________________________。
(3)气体丙与金属镁反应的产物是 Mg3N2 (用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式________________________________________________________________________
________________________________________________________________________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之 取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O (已知Cu2O+2H+===Cu+Cu2++H2O)。
(5)甲与乙之间 可能 (填“可能”或“不可能”)发生反应产生H2,判断理由是 AlH3中氢元素的化合价为-1价,NH3中含有+1价的氢元素,二者可发生氧化还原反应产生H2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:21世纪教育网版权所有

(1)MgCO3与稀硫酸反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)滤渣2的成分是 Fe(OH)3 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
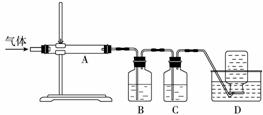
①D中收集的气体可以是 CO (填化学式)。
②B中盛放的溶液可以是 d (填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为________________________________________。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”、“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”、“等于”),此时溶液中离子浓度由大到小的顺序是______________________。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com