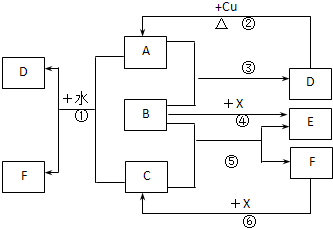
MnO2一种黑色粉末,既可用于实验室制O2的催化剂,又可以用于实验室制Cl2.某化学实验小组通过实验来探究一黑色粉末是否由MnO2、FeO组成(不含有其它黑色物质).探究过程如下:
提出假设:假设1.黑色粉末是MnO2;假设2.黑色粉末是FeO;假设3. .
设计探究实验:
取少量粉末放入足量的稀硫酸中,充分反应后.
(1)若假设1成立,则实验现象是 .
(2)若黑色粉末全部溶解,所得溶液显 ,则假设 成立.
(3)若产生 的现象,则假设3成立.
有另一小组同学提出,若混合物中FeO含量很少,可能加入足量的稀硫酸后实验现象不明显,就无法假设3是否成立.
(4)为探究假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氯水,再加入KSCN试剂,若产生 现象,则假设3成立.
【答案】分析:(1)MnO2与稀硫酸不反应;
(2)MnO2与稀硫酸不反应,FeO与稀硫酸反应生成的硫酸亚铁呈浅绿色;
(3)MnO2与稀硫酸不反应,FeO与稀硫酸反应生成的硫酸亚铁呈浅绿色;
(4)氯水具有氧化性,能将亚铁离子氧化为三价铁,三价铁遇到硫氰酸钾试剂显血红色.
解答:解:根据假设1、2,则假设3应为黑色粉末是MnO2和FeO的混合物,故答案为:黑色粉末是MnO2和FeO的混合物
(1)MnO2与稀硫酸不反应,则假设1成立时,黑色粉末不溶解,溶液不显浅绿色,
故答案为:黑色粉末不溶解,溶液不显浅绿色;
(2)若黑色粉末全部溶解,所得溶液显浅绿色,则一定不含二氧化锰,假设2成立,故答案为:显浅绿色;2;
(3)如果是假设3成立,FeO溶于稀硫酸,溶液显浅绿色,但MnO2不溶解,则产生黑色粉末部分溶解,溶液显浅绿色,
故答案为:黑色粉末部分溶解,溶液显浅绿色;
(4)氯水具有氧化性,能将亚铁离子氧化为三价铁,由于Fe3+遇KSCN溶液变血红色溶液,现象十分明显,故可通过检验
Fe3+来确定FeO存在,故答案为:黑色粉末未全部溶解,溶液变血红色.
点评:本题是一道物质的检验题目,可以根据物质的性质来回答,难度不大.