
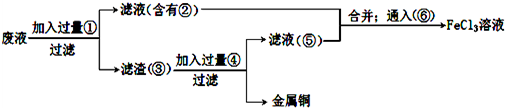
分析 Cu和FeCl3发生反应Cu+2FeCl3=2FeCl2+2CuCl2,所以废液中含有Cu2+、Fe2+,可能含有Fe3+,向废液中加入Fe粉,发生反应Cu2++Fe=Fe2++Cu,然后过滤,滤渣中含有Fe、Cu,滤液中含有FeCl2,向滤渣中加入过量稀盐酸,发生反应Fe+2HCl=FeCl2+H2,然后过滤,得到的滤渣是Cu,滤液中含有HCl、FeCl2,将滤液②⑤混合,然后通入Cl2,发生反应2FeCl2+Cl2=2FeCl3,所以得到氯化铁溶液,
(1)根据推断确定各物质化学式;
(2)合并溶液通入⑥的离子反应为亚铁离子和氯气的氧化还原反应;
(3)若向②中加入氢氧化钠溶液,先生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定,易被氧化生成氢氧化铁;
(4)若向废液中加入任意质量的①物质,Fe先和Fe3+反应后和Cu2+反应,Cu能和铁离子反应,根据离子反应先后顺序确定溶液中成分.
解答 解:Cu和FeCl3发生反应Cu+2FeCl3=2FeCl2+2CuCl2,所以废液中含有Cu2+、Fe2+,可能含有Fe3+,向废液中加入Fe粉,发生反应Cu2++Fe=Fe2++Cu,然后过滤,滤渣中含有Fe、Cu,滤液中含有FeCl2,向滤渣中加入过量稀盐酸,发生反应Fe+2HCl=FeCl2+H2,然后过滤,得到的滤渣是Cu,滤液中含有HCl、FeCl2,将滤液②⑤混合,然后通入Cl2,发生反应2FeCl2+Cl2=2FeCl3,所以得到氯化铁溶液,
(1)通过以上分析知,③Fe和Cu、⑤HCl和FeCl2,
故答案为:③Fe和Cu;⑤HCl和FeCl2;
(2)合并溶液通入⑥的离子反应为亚铁离子和氯气的氧化还原反应,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)若向②中加入氢氧化钠溶液,先生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,看到的现象是:先生成白色沉淀,迅速变为灰绿色,最后变为红褐色,
故答案为:先生成白色沉淀,迅速变为灰绿色,最后变为红褐色.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质、物质反应先后顺序是解本题关键,注意Fe、Cu混合物和含有Fe3+、Cu2+混合溶液反应先后顺序,题目难度不大


科目:高中化学 来源: 题型:解答题
 现有下列四种物质,①H2②Cl2③SO2④H2SO4请回答相关问题:
现有下列四种物质,①H2②Cl2③SO2④H2SO4请回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(N2)=v正(H2) | B. | v正(N2)=v逆(NH3) | ||
| C. | 2 v正(H2)=3 v逆(NH3) | D. | v正(N2)=v逆(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①生成的气体不能使湿润的KI-淀粉试纸变蓝 | |
| B. | 实验②证明Fe2+既有氧化性又有还原性 | |
| C. | 上述实验证明氧化性:MnO4->CI2>Fe3+>I2 | |
| D. | 上述实验中,共有两个氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g C2H4和C4H8混合气体中含有氢原子总数为4NA | |
| B. | 常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA | |
| C. | 15g 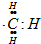 含有的电子数为9NA 含有的电子数为9NA | |
| D. | 2.1 g DTO中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-丁烯与HBr发生加成反应 | |
| B. | 3-氯戊烷与NaOH乙醇溶液共热发生消去反应 | |
| C. | 甲苯在一定条件下发生溴代反应生成一溴代甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com