
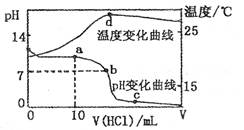
A.a点溶液中离子浓度大小的关系: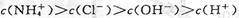 |
B.b点溶液中离子浓度大小的关系: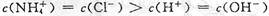 |
C.c点溶液中离子浓度大小的关系: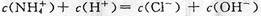 |
| D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3? H2O电离吸热 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当V(NaOH)=20mL时,溶液中离子浓度大小关系: C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.HA-的电离程度小于水解程度 |
| C.滴加过程中当溶液呈中性时,V(NaOH)<20mL |
| D.当V(NaOH)=40mL时,向所得溶液加水稀释的过程中pH增大 |
查看答案和解析>>
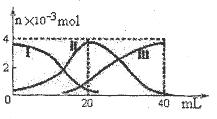
科目:高中化学 来源:不详 题型:填空题
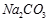 ②
②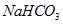 ?③
?③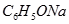 ? ④
? ④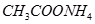 ⑤
⑤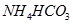 (已知酸性
(已知酸性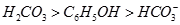 。)
。)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a一定大于0.01 |
| B.反应后溶液中一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| C.反应后溶液中一定有c(CH3COO-)+c(CH3COOH)>c(Na+) |
| D.反应后溶液中一定有c(Na+)>c(CH3COO-)>c(H+)=c(OH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同 |
| D.强电解质在固态或液态时,可能不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com