
溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B )=0.200 mol/L及c(C )=0 mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B )=0.200 mol/L及c(C )=0 mol/L。反应物A的浓度随时间的变化如图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:② ;③ 。
(2)实验②平衡时B的转化率为 ;实验③平衡时C的浓度为 。
(3)该反应的ΔH 0,其判断理由是 。
(4)该反应进行到4.0 min时的平均反应速率:实验②:v(B)= 。
(1)加催化剂;达到平衡的时间缩短,平衡时A的浓度未变 温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4) 0.06 mol/L
(3)> 升高温度平衡向正反应方向移动,故该反应是吸热反应
(4)0.014 mol/(L·min)
【解析】这是一道数形结合的反应原理试题,关键是找出图形中①②③三条曲线的转折点:达到平衡的时间①>③>②,但A的平衡浓度关系是①=②>③,说明②是使用了催化剂,③是升高温度。
(1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比,③达平衡所需时间短,平衡时浓度更小,故不可能是加催化剂,而只能是升高温度来影响反应速率的。
(2)不妨令溶液为1 L,则②中达平衡时A转化了0.04 mol,由反应计量数可知B转化了0.08 mol,所以B的转化率为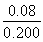 ×100%=40%;同样③中A转化了
×100%=40%;同样③中A转化了
0.06 mol,则生成C为0.06 mol,体积不变,即平衡时c(C)=0.06 mol/L。
(3)ΔH>0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正反应方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,ΔH>0。
(4)从图上读数,进行到4.0 min时,实验②A的浓度为:0.072 mol/L,则Δc(A)=0.100-0.072=0.028(mol/L),v(A)=Δc(A)/Δt=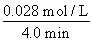 =
=
0.007 mol/(L·min),所以 v(B)=2v(A)=0.014 mol/(L·min)。


科目:高中化学 来源:2014年化学高考总复习课时演练 9-1原电池 化学电源练习卷(解析版) 题型:选择题
某小组为研究电化学原理,设计装置。下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-2水的电离和溶液的酸碱性练习卷(解析版) 题型:选择题
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(解析版) 题型:填空题
在5 L密闭容器中加入2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡移动 (填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g)再次达到平衡后,H2物质的量为 __________mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件是 _________。

查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(解析版) 题型:选择题
当反应COCl2(g) CO(g)+Cl2(g) ΔH>0达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO的浓度
④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-1化学反应速率及影响因素练习卷(解析版) 题型:选择题
在一定条件下的密闭容器中存在下列四个平衡体系,增大容器的体积对化学反应速率没有影响的是( )
A.2SO2+O2 2SO3
2SO3
B.CO+H2O(g) CO2+H2
CO2+H2
C.CO2(g)+H2O H2CO3
H2CO3
D.Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 6化学反应与能量练习卷(解析版) 题型:填空题
当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。CO2与H2反应制备CH3OH和H2O的化学方程式为 。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式 。
(3)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-889.6 kJ·mol-1 ①
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-3化学键练习卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是( )

A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 4-4氮及其重要化合物练习卷(解析版) 题型:选择题
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被溶液充满,关于原来试管中盛装的气体不正确的猜测是( )

A.可能是N2与NO2的混合气体
B.可能是O2与NO2的混合气体
C.可能是NO与NO2的混合气体
D.可能是NO2一种气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com