
【题目】下列气体中,不能用排空气法收集的是( )
A. NOB. NO2C. CO2D. SO2
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3的制备分两步进行,反应的化学方程式如下:
i. 2Na +2NH3![]() 2NaNH2+ H2 ii. NaNH2+ N2O
2NaNH2+ H2 ii. NaNH2+ N2O![]() NaN3+H2O
NaN3+H2O
实验室利用如下装置模拟工业级NaN3的制备。
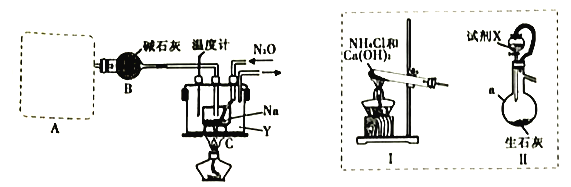
(1)装置A用于制取NH3,右图装置I和Ⅱ为气体发生装置。若选用装置I,则发生反应的化学方程式为_________________________________;若选用装置Ⅱ,则试剂X是___________(填试剂名称),仪器a的名称是___________。
(2)装置B的作用是_______________________________________________________。
(3)加热前需要先往装置C中通一段时间NH3的目的是______________________________。
(4)当观察到装置C中熔融钠单质的银白色光泽全部消失时,停止通氨气,开始通入N2O。装置C中的Y为___________(填字母)。
A.冷水浴 B.热水浴 C油浴
(5)该实验装置的缺陷是_________________________________(任写一点)。
(6)反应完全结束后,取出装置C中的混合物先后经加水、加乙醇、过滤、洗涤、干燥等操作得到NaN3固体,其中洗涤操作可用乙醚洗涤NaN3固体的原因___________。
(7)实验室用滴定法测定叠氮化钠产品中NaN3的质量分数:
操作方法:取2.500g产品配制成500.0mL溶液。取25.00mL溶液置于锥形瓶中,加入25.00mL0.1010mol·L-1(NH4)Ce(NO3)6溶液。充分反应后,稍稀释,加入4mL浓硫酸,滴入邻菲罗啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗(NH4)2Fe(SO4)2标准溶液的体积为14.80mL。
测定过程发生反应的方程式为:
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
产品中NaN3的质量分数为___________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4溶液为电解质溶液。下列有关说法不正确的是

A. a极为负极,电子由a极经外电路流向b极
B. a极的电极反应式:H2-2e-===2H+
C. 电池工作一段时间后,装置中c(H2SO4)增大
D. 若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨在一定条件下发生如下反应:![]() ,当进入合成塔的
,当进入合成塔的![]() 和
和![]() 的体积比为1:3时,经测定,在一定温度、压强和催化剂条件下所得氨的平衡浓度(体积分数)如下表所示:
的体积比为1:3时,经测定,在一定温度、压强和催化剂条件下所得氨的平衡浓度(体积分数)如下表所示:
20MPa | 50MPa | |
500℃ | 19.1 | 42.2 |
而实际从合成塔出来的混合气体中含有氨约15%。
完成下列填空:
(1)目前公认的合成氨工业最恰当的催化剂是________。
a.酶 b.二氧化锰 c.铁触媒 d.五氧化二钒
(2)298K时合成氨,每生成![]() ,同时放出46.2kJ的热量。则该反应的热化学方程式为__________;该温度下,取
,同时放出46.2kJ的热量。则该反应的热化学方程式为__________;该温度下,取![]() 和
和![]() 放在一密闭容器中,在催化剂条件下反应,测得反应放出的热量总小于92.4kJ,其原因是________________________________。
放在一密闭容器中,在催化剂条件下反应,测得反应放出的热量总小于92.4kJ,其原因是________________________________。
(3)合成氨的温度和压强通常控制在约500℃以及20-50MPa的原因是_________________________________。
(4)实际上从合成塔出来的混合气体中氨的体积分数小于理论值的原因是________。
a.表中所测数据有明显误差 b.生成条件控制不当
c.氨的分解速率大于预测值 d.合成塔中的反应未达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com