
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 2.2 g D218O中含中子数为NA
B. 22.4 L( 标准状况)乙醇含-OH数目为NA
C. 向1L pH=3的醋酸中加入足量氨水,生成CH3COO-数目为1×10-3NA
D. 反应Cl2 +2NaClO2=2ClO2 +2NaCl,每生成1mol ClO2转移电于数为NA
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
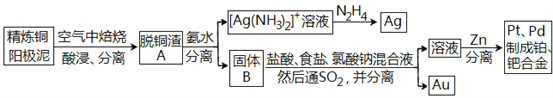
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和_______。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为________________。
(3)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为______,该反应的离子方程式为____________________。
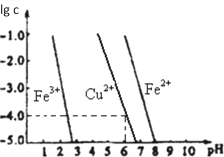
(5)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合如图分析:(其中的纵坐标代表金属阳离子浓度的对数)
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是_______________,然后加入适量的CuO调节pH=3.7,除去______离子;
②从图中数据计算可得Cu(OH)2的Ksp约为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化在给定条件下能实现的是( )
①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3 ![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO.
MgO.
A.4项
B.3项
C.2项
D.1项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20.0 mL 0.10mol/L 氨水中滴入0.10 mol/L的盐酸。溶液的pH与所加盐酸的体积关系如图所示。已知氨水的电离度为1.32%,下列有关叙述正确的是( )
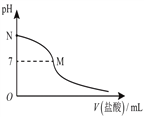
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中![]()
D. N点处的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水制取氯气、烧碱、溴及镁等工艺示意图如下:
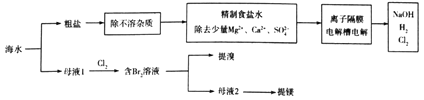
下列说法正确的是
A. “精制食盐水”时药品使用顺序为Na2CO3(aq)、NaOH(aq)、BaCl2(aq)及盐酸
B. 使用离子隔膜电解槽电解饱和食盐水时,其中的“隔膜”是“阳离子交换膜”
C. 工业上“母液1”氧化得到“含Br2溶液”后可直接用CCl4萃取,然后蒸馏得粗溴
D. “母液2”需经过加石灰乳生成沉定Mg(OH)2、过滤、盐酸溶解,然后直接电解得到镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合材料的使用使导弹的射程有了很大的提高,其主要原因是( )
A.复合材料的使用可以使导弹经受超高温的变化
B.复合材料的使用可以使导弹的质量减轻
C.复合材料的使用可以使导弹承受温度的剧烈变化
D.复合材料的使用可以使导弹承受超高强度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,在一定条件下既能起加成反应,也能起取代反应,但不能使KMnO4酸性溶液褪色的是( )
A. 乙烷 B. 苯 C. 乙烯 D. 乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com