
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
【答案】 +3 H3AsO4![]() H++H2AsO4- 沉淀过量的S2-,使As2O3(a)+3S2-(aq)
H++H2AsO4- 沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq) 平衡左移,提高沉砷效果。 H3AsO3+H2O2=H3AsO4+H2O CaSO4
2AsS32-(aq) 平衡左移,提高沉砷效果。 H3AsO3+H2O2=H3AsO4+H2O CaSO4 ![]() 12Ag++2AsH3+3H2O=12Ag+As2O3+12H+ 不符合 因为该废渣砷含量最少为(3.0×10-6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排放标准4.0×10-5g/kg
12Ag++2AsH3+3H2O=12Ag+As2O3+12H+ 不符合 因为该废渣砷含量最少为(3.0×10-6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排放标准4.0×10-5g/kg
【解析】(1)①亚砷酸(H3AsO3)中,氧元素化合价为-2价,氢元素化合价为+1价,砷元素化合价设为x,+1×3+x+(-2)×3=0,x=+3,故答案为:+3;
②第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,水溶液中分步电离,电离方程式为:H3AsO4H++H2AsO4-,故答案为:H3AsO4H++H2AsO4-;
③“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-2AsS32-使平衡逆向进行,提高沉砷效果,故答案为:除去过量的硫离子,As2S3+3S2-2AsS32-使平衡逆向进行,提高沉砷效果;
④“二级沉砷”中H2O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;,反应的化学方程式为:H3AsO3+H2O2=H3AsO4+H2O,故答案为:H3AsO3+H2O2=H3AsO4+H2O;
⑤流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀、和铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4,故答案为:CaSO4;
(2)①AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
②将AsH3气体通人AgNO3溶液中,生成银镜和As2O3,结合电荷守恒、原子守恒配平书写离子方程式为:12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+,故答案为:12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+;
③As的最低检出限为3.0x10-6g,取1g废渣样品,重复上述实验,未见银镜生成,取10g废渣样品最后生成银镜和As2O3.则10g废渣含砷量最少为3.0x10-6g,含砷量大于3.0×10-4g/kg>4.0×10一5gkg-1,不符合排放标准,故答案为:不符合;因为该废渣砷含量最少为(3.0×10-6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排放标准4.0×10-5g/kg。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,2.24LCCl4含有的共价键数为0.42NA
B. 氢原子数为0.4NA的甲醇分子中含有的键数为0.4NA
C. 1![]() Fe溶于过量硝酸,电子转移数为2NA
Fe溶于过量硝酸,电子转移数为2NA
D. 14![]() 乙烯和丙烯混合气体中的氢原子数为2NA
乙烯和丙烯混合气体中的氢原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·贵州省遵义市第四中学高一上学期期中考试)由NO和CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),下列关系正确的是
A.混合气体中,CO与NO质量比15∶14
B.混合气体中,CO与NO分子个数比1∶2
C.混合气体中,CO占有的体积大于NO占有的体积
D.混合气体中,CO与NO密度比14∶15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.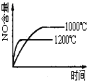 B.
B.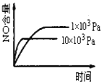 C.
C.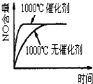 D.
D.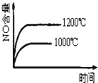
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物,它的合成路线如下:

(1)由B→C的反应类型为 。
(2)C分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式 。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(6)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(![]() )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚(  )和乙醇为原料制备
)和乙醇为原料制备  的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeOCr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:
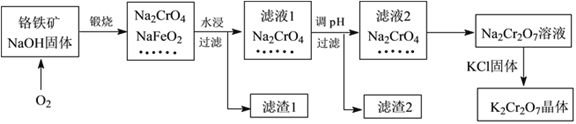
已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
请回答下列问题:
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有(填化学式)_________________;
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是_______(填字母代号);
a.溶液的颜色不变
b.v (CrO42—)= 2v (Cr2O72—)
c.Cr2O72—和CrO42—的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O72—和CrO42—,常用还原沉淀法处理。该方法的工艺流程为:
![]()
(4)请写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式___________________;
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,溶液的pH应调至__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl=AgCl↓+KNO3。将含有少量氯化钾的硝酸钾固体提纯,某学生如图所示的实验操作。回答下列问题:

(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是___________。
(2)向溶液中加入适量的________溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误:①__________________;②______________________。
(4)为了从液体中得到硝酸钾晶体,可选用的两种结晶方法是:① __________________________ ;②______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com