
| 选项 | 实验操作及现象 | 实验结论或实验目的 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 溶液中有Na+,无K+ |
| B | 向硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 非金属性:Cl>Si |
| C | 向Ba(NO3)2溶液中通入SO2,有白色沉淀产生 | SO2具有还原性 |
| D | 将含少量KNO3杂质的NaCl晶体制成热的饱和溶液,冷却结晶,过滤 | 除去NaCl中的KNO3杂质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.K元素的焰色反应必须透过蓝色的钴玻璃观察;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
C.二氧化硫和硝酸钡发生氧化还原反应生成硫酸钡白色沉淀;
D.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离.
解答 解:A.K元素的焰色反应必须透过蓝色的钴玻璃观察,滤去黄光的干扰,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,所以不能比较非金属性强弱,故B错误;
C.二氧化硫和硝酸钡发生氧化还原反应生成硫酸钡白色沉淀,该反应中二氧化硫是还原剂、硝酸钡是氧化剂,二氧化硫体现还原性,故C正确;
D.硝酸钾和氯化钠的溶解度随温度的变化不同,硝酸钾溶解度变化较大,将混合物制成热饱和溶液,冷却结晶,得到的固体仍为氯化钠和硝酸钾的混合物,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、氧化还原反应、非金属性强弱比较、焰色反应等知识点,明确实验原理、物质性质是解本题关键,侧重于学生的分析能力、实验能力和评价能力的考查,易错选项是D.


科目:高中化学 来源: 题型:选择题
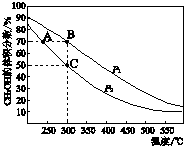 CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )| A. | P1<P2 | B. | 该反应的△H>0 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(S04)3溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-=3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一=2MnOOH+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4<HBrO4<HClO4 | B. | 原子半径大小:Na>O>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
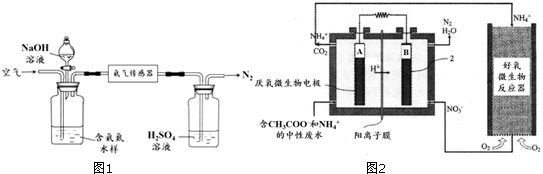
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
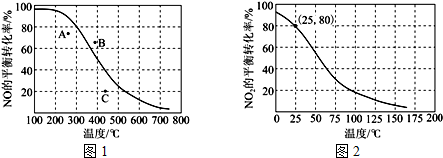
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com