
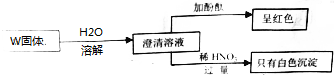
| A. | 一定不存在③⑥ | B. | 可能存在①② | C. | 一定存在①④⑦ | D. | 至少存在④⑤⑦ |
分析 此固体投入水中得到澄清溶液,说明能相互反应生成沉淀的物质不能共存其中,该溶液可使酚酞呈红色,说明溶液显碱性,若向该溶液中加入稀硝酸至过量,有白色沉淀生成,说明沉淀是氯化银,据此解答即可.
解答 解:白色固体投入水中得到澄清溶液,证明固体都溶于水,相互反应生成的也是互溶物,相互反应不会产生沉淀,溶液时酚酞呈红色,说明溶液为碱性,即一定含有⑦NaOH,此时一定不能存在①CuCl2和⑥FeCl2,向溶液中加入过量的稀硝酸,有沉淀,那么只能是AgCl沉淀,因此一定含有⑤AgNO3,要使得存在⑤AgNO3和⑦NaOH的情况下没有沉淀,只能生成银氨溶液,因此一定含有④NH4Cl,对于②AlCl3,如果NaOH过量的话,能生成NaAlO2,也是溶于水的,因此可能存在,③NaNO2也是可能存在.即一定存在④⑤⑦,可能存在②③,一定不存在:①和⑥;综合以上分析只有D正确,故选D.
点评 本题考查学生物质之间的反应以及现象的有关知识,可以根据所学知识来回答,难度较大.


科目:高中化学 来源: 题型:选择题
 如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )
如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )| 选项 物质 | A | B | C | D |
| X | H2S | SO2 | CO2 | Cl2 |
| Y | 浓硫酸 | NaHCO3饱和溶液 | Na2SO3 溶液 | NaHSO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的硝化、乙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| C. | 乙烯、苯、乙烷分子中的所有原子都在同一平面上 | |
| D. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
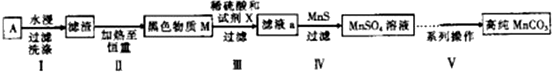
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.3595 |
| 2 | 铁粉 | 2.7184 |
| 3 | 硫化亚铁 | 2.9911 |
| 4 | 30%过氧化氢 | 3.7349 |
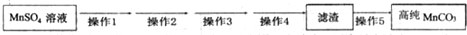
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 二甲苯一溴代物的熔点/℃ | 234 | 206 | 213 | 204 | 214 | 205 |
| 对应的二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. | 熔点为234℃的是一溴代间二甲苯 | B. | 熔点为234℃的是一溴代邻二甲苯 | ||
| C. | 熔点为-54℃的是间二甲苯 | D. | 熔点为-27℃的是对二甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com