
【题目】下列变化需要加入适当的氧化剂才能完成的是( )
A.CuO→Cu B.Fe→FeCl2 C.H2SO4→H2 D.HNO3→N2
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不饱和的脂肪酸是常见保健食品,DHA(分子式为C22H32O2)是近年来备受关注的一种不饱和高级脂肪酸(分子中只含有双键),它对大脑的生长发育具有重要的意义,许多海洋生物食品中含有丰富的DHA。在一个DHA分子中含有的碳碳双键数为( )个
A. 4B. 5C. 6D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s)+n B(g)![]() e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:

下列叙述正确的是( )
A. 达平衡后,若升温,则K减小
B. 达平衡后,加入催化剂C%增大
C. 化学方程式中n>e+f
D. 达平衡后,若增加A的量,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生吸氧腐蚀时,正极发生的电极反应是( )
A. 2H2O+O2+4 e-=4OH-B. Fe2++2e-=Fe
C. 2H++2e-=H2↑D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为 ( )
A.元素 B.单质 C.分子 D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
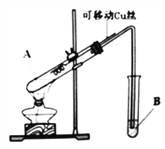
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com