
用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.2.24 L CO2中含有原子数为0.3NA
B.1.8 g NH4+离子中含有的质子数为NA
C.C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA
D.0.5 mol·L-1 NaOH溶液中,含Na+数目为0.5NA
科目:高中化学 来源:2014年高考化学 题型十 粒子变化型专题练习卷(解析版) 题型:选择题
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是( )
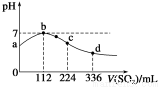
A.原H2S溶液的物质的量浓度为0.05 mol·L-1
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型五 物质结构型专题练习卷(解析版) 题型:选择题
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是( )
A.非金属性A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.原子半径A>B>C
D.阴离子还原性C3->B2->A-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型九 速率平衡型专题练习卷(解析版) 题型:选择题
密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )
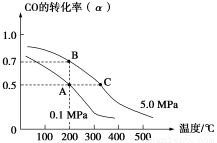
A.若A、B两点表示在某时刻达到的平衡状态,此时A、B两点时容器中,n(A)总∶n(B)总=4∶5
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA<tC
C.设B、C两点的平衡常数分别为KB、KC,则KB<KC
D.在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型三 NA应用型专题练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法一定正确的是( )
A.25 ℃,pH=13的NaOH溶液中含有OH-为0.1NA
B.1 L 0.1 mol·L-1 CuSO4溶液中含有Cu2+为0.1NA
C.2.24 L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA
D.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型七 网络构建型专题练习卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是( )
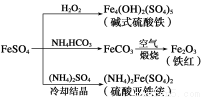
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型七 网络构建型专题练习卷(解析版) 题型:选择题
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是( )
选项XYZ箭头上所标数字的反应条件
ASiO2Na2SiO3H2SiO3①与Na2CO3熔融
BNaClNaHCO3Na2CO3②加热
CN2NO2HNO3③加热
DCCOCO2④灼热炭粉
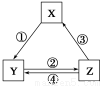
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学训练2.2.2分子空间构型分子性质练习卷(解析版) 题型:选择题
判断下列分子为手性分子的是( )。
A.CH2Cl2
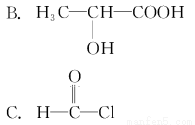
D.CH3CH2COOCH2CH3
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(解析版) 题型:填空题
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1 073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是___________________________________________________________________________。
CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
请回答下列有关问题:
估计钙元素的电负性的取值范围:________<X<________。经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中形成的化学键的类型及其理由:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com