
| A. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S | |
| B. | 用右图装置电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | NaHCO3溶液使酚酞试液变红:HCO3-+H2O?H3O++CO32- | |
| D. | 用AlCl3溶液使石蕊试液变红:Al3++3H2O?Al(OH)3+3 H+ |
分析 A.硫离子为多元弱酸根,分步水解;
B.铜为活性电极,电极本身放电;
C.碳酸氢根离子水解生成碳酸和氢氧根离子;
D.铝离子为弱碱阳离子,水解生成氢氧化铝和氢离子.
解答 解:A.Na2S溶液使酚酞试液变红,离子方程式:S2-+H2O?OH-+HS-,故A错误;
B.用右图装置电解CuSO4溶液:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑,故B错误;
C.NaHCO3溶液使酚酞试液变红,离子方程式:HCO3-+H2O?OH-+H2CO3,故C错误;
D.用AlCl3溶液使石蕊试液变红,离子方程式:Al3++3H2O?Al(OH)3+3 H+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查盐类的水解,明确盐类水解规律是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
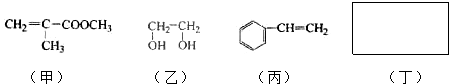
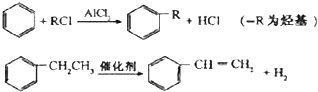
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③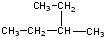 ④
④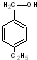 ⑤
⑤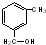 ⑥
⑥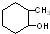
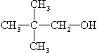 .
.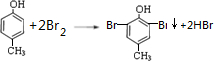 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com