
可逆反应在一定条件下达到化学平衡时,下列说法正确的是
A.正反应速率等于逆反应速率,且都为零
B.反应物和生成物的浓度相等
C.反应体系中混合物的组成保持不变
D.断开化学键吸收的能量等于形成化学键所放出的能量
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2017届河北邯郸市高三上学期第二次月考化学试卷(解析版) 题型:选择题
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是( )

A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJ•mol﹣1
B.石墨的稳定性强于金刚石
C.石墨和金刚石的转化是物理变化
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
①Na2O、Fe2O3、Al2O3属于碱性氧化物,CO2、SO2、NO2都能和碱溶液发生反应属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉主要成分之一,Na2CO3可冶疗胃酸过多
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③⑤ B.④⑤⑥ C.②③④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
已知氧化性:Br2 > Fe3+ > I2,向含a mol FeI2的溶液中加入含b mol Br2的溴水,充分反应。下列说法不正确的是
A.离子的还原性强弱:I- > Fe2+ > Br-
B.当a≥b时,发生的离子反应:2I- + Br2 = I2 + 2Br-
C.当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5
D.当3a≤2b时,发生的离子反应:2Fe2+ + 2I- + 2Br2 = 2Fe3+ + I2 + 4Br-
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
碱性电池具有容量大,放电电流大的特点,因而得到广泛的应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn + 2MnO2 + 2H2O = Zn(OH)2 + MnOOH,下列说法不正确的是:
A.电池工作时锌为负极
B.电池正极的电极反应式为:2MnO2 + 2H2O + 2e- = 2MnOOH + 2OH-
C.电池工作时,电解液的OH-移向正极
D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解呈碱性的是
A.NH4Cl B.MgSO4 C.KOH D.NaClO
查看答案和解析>>
科目:高中化学 来源:2017届西藏自治区拉萨中学高三上第一次月考化学卷(解析版) 题型:推断题
化合物D是硅橡胶的稳定剂,其合 成路线如下图:
成路线如下图:
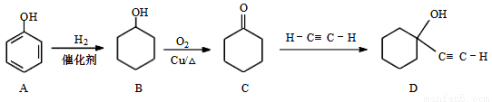
(1)B的分子式为 ; C中官能团名称 。
(2)C→D的反应类型为 。
(3)B→C的化学方程式为 。
(4)化合物D可能具有的性质有 (选填序号)。
a.加成反应 b.与FeCl3溶液发生显色反应 c.消去反应 d.酯化反应
(5)化合物B经3步反应可制备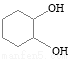 ,反应类型依次是 (选填序号)。
,反应类型依次是 (选填序号)。
a.加成、取代、消去 b.取代、消去、加成 c.消去、加成、取代
(6)写出同时满足下列条件的A的一种同分异构体的结构简式 。
①核磁共振氢谱只有一个峰 ②分子中没有碳碳双键也无环状结构
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
氯酸镁Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:
①.卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②.四种化合物的溶解度(S)随温度(T)变化曲线如图所示。回答下列问题:

(1).过滤时主要的玻璃仪器有
(2).加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是
(3).加入H2O2溶液的作用是: ;加入MgO的作用是
(4).滤渣的主要成分为 。
(5).向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2 + 2NaClO3 = Mg(ClO3)2↓ + 2NaCl,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6).产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2: 取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-)
②产品中Mg(ClO3)2·6H2O的质量分数为 【Mg(ClO3)2·6H2O的相对分子质量为299,列出表达式即可)】
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省大连市高三上学期10月月考化学试卷(解析版) 题型:实验题
ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
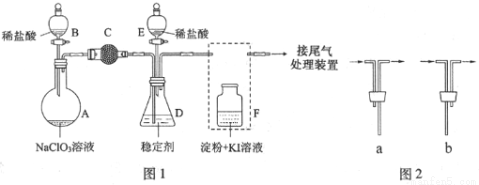
(1)仪器D的名称是_______,安装F中导管时,应选用图2中的___________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___________。
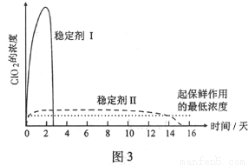
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是___________,原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com