
分析 分子式为C5H12O的有机物,可与金属钠反应产生氢气,故为醇类,官能团为-OH.
(1)若该有机物可催化脱氢氧化成醛,故结构中一定含-CH2OH,而不能发生消去反应,故-CH2OH所连的C原子上无H原子,据此分析;
(2)若该有机物不能催化脱氢氧化成含羰基化合物,故此有机物中-OH所在的C原子上无H原子,或-OH所在的C原子上有两个H原子;而能发生消去反应生成烯烃,故-OH所在C的相邻C原子上有H原子,据此分析;
(3)分子式为C5H12O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为戊醇,书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目.
解答 解:分子式为C5H12O的有机物,可与金属钠反应产生氢气,故为醇类,官能团为-OH.
(1)若该有机物可催化脱氢氧化成醛,故结构中一定含-CH2OH,而不能发生消去反应,故-CH2OH所连的C原子上无H原子,故有机物的结构简式为:(CH3)3CCH2OH,故答案为:(CH3)3CCH2OH;
(2)若该有机物不能催化脱氢氧化成含羰基化合物,故此有机物中-OH所在的C原子上无H原子,或-OH所在的C原子上有两个H原子;而能发生消去反应生成烯烃,故-OH所在C的相邻C原子上有H原子.
由上分析可知,若-OH所在的C原子上无H、-OH所在C的相邻C原子上有H的话,此有机物的结构简式为:(CH3)2C(OH)CH2CH3;若-OH所在的C原子上有2个H、-OH所在C的相邻C原子上有H的话,此有机物的结构简式为:CH3CH2CH2CH2CH2OH、(CH3)2CHCH2CH2OH和HOCH2CH(CH3)2CH2CH3,
故答案为:(CH3)2C(OH)CH2CH3;CH3CH2CH2CH2CH2OH;(CH3)2CHCH2CH2OH;HOCH2CH(CH3)2CH2CH3;
(3)分子式为C5H12O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为戊醇,戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CH2CH(CH3)CH2CH3、-C(CH3)2CH2CH3、-CH(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,所以该有机物的可能结构有8种.故答案为:8.
点评 本题考查有机物的推断、同分异构体的书写等,难度中等,利用烃基异构判断,比书写戊醇的同分异构体简单容易.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
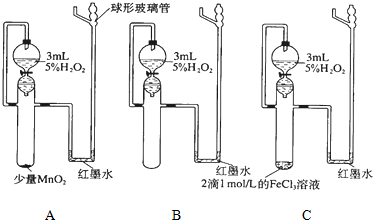
| 实验目的 | 催化剂对过氧化氢分解化学反应速率影响 | ||
| 实验步骤 | 在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体.同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况. | ||
| 反应条件 | A少量MnO2 | B无催化剂 | C 2滴FeCl3溶液 |
| 实验现象 | |||
| 反应速 率大小 | (用v (A)、v (B)、v (C)表示) | ||
| 得出结论 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
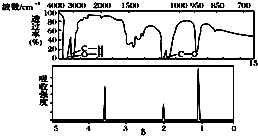
| A. | 由核磁共振氢谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由红外光谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 操作 | 现象 |
| A | 比较酸性:HF>H2CO3 | 向盛有少量NaHCO3溶液的试管中滴加足量HF溶液 | 有无色气体产生 |
| B | 验证SO2的漂白性 | 将SO2通入石蕊溶液中 | 石蕊溶液褪色 |
| C | 比较非金属性:Br>I | 将溴水滴加到KI-淀粉溶液中 | 溶液变蓝 |
| D | 检验某溶液中是否含有SO42- | 向盛有少量待测液的试管中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
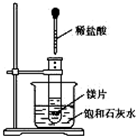 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题.
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题. 、
、 、
、 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com