
将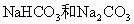 的混合物14.8g溶于水配成稀溶液,在此溶液中加入12.4g碱石灰(主要成分是NaOH和CaO),充分反应后,如果溶液中的
的混合物14.8g溶于水配成稀溶液,在此溶液中加入12.4g碱石灰(主要成分是NaOH和CaO),充分反应后,如果溶液中的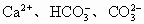 全部转化为沉淀物,再将溶液蒸干,最后可以得到29g白色固体物质.求:
全部转化为沉淀物,再将溶液蒸干,最后可以得到29g白色固体物质.求:
(1)原混合物中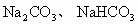 各为多少克?
各为多少克?
(2)29g白色固体的成分及质量分数.
科目:高中化学 来源: 题型:
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 、
、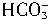 ,然后将体系中的水分蒸干,得29.0g白色固体。求:
,然后将体系中的水分蒸干,得29.0g白色固体。求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com