
下图中的实验装置可以用于实验室制取乙炔。请填空:
(1) 图中A管的作用是 ,
制取乙炔的化学反应方程式为 。
(2)乙炔通入酸性KMnO4溶液中,发生 反应,可以观察到
现象,若通入溴水中,发生 反应。
(3)乙炔燃烧的化学方程式为 ,燃烧时的现象为 ,
为了安全,点燃乙炔前应该先 。
(1)调节水面的高度来控制反应的发生和停止
CaC2+H2O Ca(OH)2+
Ca(OH)2+ ↑(2)氧化 紫色酸性高锰酸钾溶液逐渐褪色 加成
↑(2)氧化 紫色酸性高锰酸钾溶液逐渐褪色 加成
(3)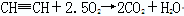 明亮火焰 黑色浓烟 验纯
明亮火焰 黑色浓烟 验纯
解析试题分析:(1) 图中A管是可以上下移动的,所以可以通过调节水面的高度来控制反应的发生和停止。实验室制取乙炔的化学方程式是CaC2+H2O Ca(OH)2+
Ca(OH)2+ ↑。
↑。
(2)乙炔含有碳碳三键,能被酸性高锰酸钾溶液氧化,也能和溴水发生加成反应,所以乙炔通入酸性KMnO4溶液中,发生氧化反应,可以观察到紫色酸性高锰酸钾溶液逐渐褪色;若通入溴水中,发生加成反应。
(3)乙炔是可燃性气体,点燃前相应检验乙炔的纯度。由于乙炔中含碳量高,所以燃烧时有黑色浓烟生成,反应的化学方程式是2HCH2+5O2 4CO2+2H2O。
4CO2+2H2O。
考点:考查乙炔的实验室制备、乙炔的化学性质
点评:该题是基础性试题的考查,难度不大。试题贴近教材,基础性强,旨在巩固学生的基础,提高学生的应试能力。明确乙炔的实验室制备原理、乙炔的结构特点和性质特点,是答题的关键。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:实验题
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
已知装置②中发生的主要反应依次为:CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是 。
(2)装置②中,生成需由装置③除去的物质的离子方程式为 。
(3)反应结束后,缓缓通入空气的目的是 。
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |

| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下: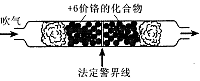
金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:
当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
| A.反应中发生转移的电子个数为3nx |
| B.该废水中c(Cr2O2-7)为50nx mol/L |
| C.消耗硫酸亚铁铵的物质的量为n(l+y)mol |
| D.在FeO·FeyCrxO3中,x+y=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与人类生产、生活,社会可持续发展密切相关。下列说法正确的是
| A.蔬菜表面洒少许福尔马林,可保鲜和消毒 |
| B.绿色食品就是不使用化肥农药,不含任何化学物质的食品 |
| C.推广纳米TiO2光触媒技术铺设“生态马路”,将汽车尾气转化为无害物质 |
| D.推广使用煤液化技术可减少二氧化碳温室气体气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
食用下列食品通常不会对人体健康造成危害的是 ( )
| A.用甲醛溶液浸泡的海鲜 | B.用工业食盐腌制的泡菜 |
| C.用工业酒精配制的白酒 | D.牛奶经发酵后得到的酸奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与生活、社会密切相关。下列有关说法中,错误的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,均不可食用 |
| C.为防止电池中的重金属污染土壤和水体,应积极开发废电池的综合利用 |
| D.减少机动车尾气的排放,可以减少雾霾的发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com