A、B分别是碳原子数相同的烷烃和烯烃.现有2L A、B的混合气体在氧气中充分燃烧,生成8L二氧化碳和9.2L水蒸气(气体的体积均在同温同压下测定).
(1)试推测A与B的分子式;若有同分异构现象,写出烷烃A同分异构体的结构式.
(2)求混合气体中各组分的体积百分数.
【答案】
分析:(1)体积之比等于物质的量之比,根据碳原子守恒确定A、B分子中碳原子数目,再根据烷烃、烯烃的组成通式确定A、B的分子式;根据A的分子式书写同分异构体;
(2)根据生成的水蒸气体积,利用H原子守恒计算混合气体中平均H原子数目,令A的体积分数为x,则B为1-x,根据平均H原子数目列方程,据此解答.
解答:解:(1)体积之比等于物质的量之比,故n(有机物):n(CO
2)=2L:8L=1:4,
根据C原子守恒可知,混合气体中平均分子组成中N(C)=4,
A、B分别是碳原子数相同的烷烃和烯烃,故分子中都含有4个C原子,故A为C
4H
10,B为C
4H
8,
C
4H
10的同分异构体的结构式有:
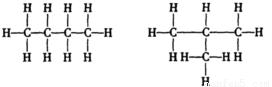
,
答:A为C
4H
10,B为C
4H
8;A的同分异构体有
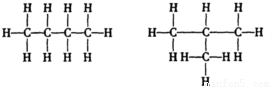
.
(2)体积之比等于物质的量之比,故n(有机物):n(H
2O)=2L:9.2L=1:4.6,
根据C原子守恒可知,混合气体中平均分子组成中N(H)=
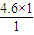
=9.2,
令A为C
4H
10的体积分数为x,则C
4H
8的体积分数为1-x,根据平均H原子数目有:
10x+8(1-x)=9.2,
解得x=0.6
故C
4H
8的体积分数为1-x=1-0.6=0.4,
答:C
4H
10的体积分数为0.6,C
4H
8的体积分数为0.4.
点评:本题考查有机物分子式的确定,难度不大,注意利用平均C值、平均H值法进行的解答.

 ,
, .
.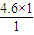 =9.2,
=9.2,
