
(6分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_________?
(2)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(3)将50 mL 0.1 mol·L-1 NaCl和50 mL 0.5 mol·L-1 CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c (Cl-)为?______________。
(每空2分,共6分)(1)0.25mol (2)0.1mol/L (3)0.55mol/L
【解析】
试题分析:(1)根据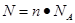 可知,含有6.02×1023个氧原子物质的量是
可知,含有6.02×1023个氧原子物质的量是
6.02×1023÷6.02×1023/mol=1mol。所以根据硫酸的化学式H2SO4可知,硫酸的物质的量是1mol÷4=0.25mol。
(2)根据n=m/M可知,4g氢氧化钠的物质的量是4g÷40g/mol=0.1mol。依据c=n/V可知,该溶液的浓度是0.1mol÷1L=0.1mol/L。由于溶液是均一的,所以取出的10ml溶液其浓度还是0.1mol/L。
(3)混合前氯化钠和氯化钙中氯离子的物质的量分别是0.05L×0.1mol/L=0.005mol、0.05L×0.5mol/L×2=0.05mol。所以混合后氯离子的物质的量是0.005mol+0.05mol=0.055mol。而溶液的体积是100ml,所以混合后氯离子浓度是0.055mol÷0.1L=0.55mol/L。
考点:考查物质的量的有关计算
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式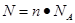 、n=m/M、
、n=m/M、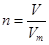 、
、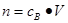 ,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。如果是计算溶液中离子浓度,还需要注意溶质的化学式以及对应的电离方程式,才能准确计算某离子浓度。如果是计算离子的物质的量,还需要注意溶液的体积变化。
,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。如果是计算溶液中离子浓度,还需要注意溶质的化学式以及对应的电离方程式,才能准确计算某离子浓度。如果是计算离子的物质的量,还需要注意溶液的体积变化。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| m |
| (m+1000) |
| m |
| (m+1000) |
| 18V |
| 11.2 |
| 18V |
| 11.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2MNA |
| M |
| 2MNA |
| M |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市梁山二中高一上学期期中考试化学试卷 题型:填空题
(12分).现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为______ __
(2)该气体所含原子总数为 个。
利用“化学计量在实验中的应用”的相关知识进行填空
(3)含有6.02×1023个氧原子的H2SO4的物质的量是_______
(4)与标准状况下VLCO2所含氧原子数目相同的水的质量是_____ __
(5)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是__________ _____
(6)三种正盐的混合溶液中含有0.2 mol Na+、0 .25 mol M
.25 mol M g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___ ________
g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___ ________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com