
| A. | K+、Ca2+、Cl-、CO32- | B. | Fe2+、Al3+、NO3-、SO42- | ||
| C. | Mg2+、NH4+、CO32-、H+ | D. | Na+、Br-、ClO-、H+ |
分析 A.钙离子与碳酸根离子反应生成碳酸钙沉淀;
B.四种离子之间不反应,能够共存;
C.镁离子、氢离子与碳酸根离子反应;
D.次氯酸根离子与氢离子结合生成次氯酸.
解答 解:A.Ca2+、CO32-之间反应生成碳酸钙,在溶液中不能大量共存,故A错误;
B.Fe2+、Al3+、NO3-、SO42-之间不发生反应,在溶液中能够大量共存,故B正确;
C.H+与Mg2+、CO32-发生反应,在溶液中不能大量共存,故C错误;
D.ClO-、H+之间反应生成次氯酸,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁条燃烧可用泡沫灭火器灭火 | |
| B. | 工业上电解氯化钠、氯化镁溶液制取可以得到金属钠、镁 | |
| C. | 通常情况下,铁是银白色金属,硬度较大,可以被磁石吸引 | |
| D. | 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中 | |
| B. | 水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去 | |
| C. | 洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少 | |
| D. | FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素,若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶 | ③若溶液变为红色,说明产物中含+3价铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓ | |
| B. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
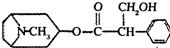
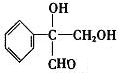 或
或 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
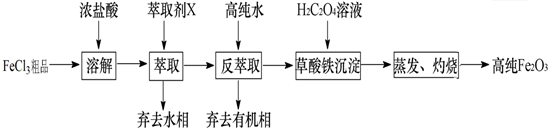
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com