



 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:

| A、图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | B、图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | C、图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | D、图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
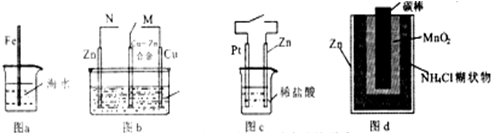
| A、图a中.插人海水中的铁棒,越靠近底端腐蚀越严重 | B、图c中,接通开关时,Zn腐蚀速率增大,Zn上放出气体的速率也增大 | C、图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | D、图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com