
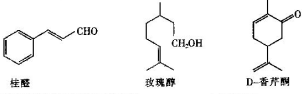
 .
.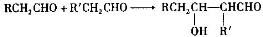
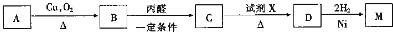
 ;
; .
. 分析 (1)桂醛中含有官能团为碳碳双键和醛基、玫瑰醇中官能团为碳碳双键和醇羟基、D-香芹酮中官能团为碳碳双键和羰基;
(2)桂醛和玫瑰醇结构差别在于桂醛中含有醛基、玫瑰醇中含有醇羟基,醛能发生银镜反应或和新制氢氧化铜悬浊液发生氧化反应生成砖红色沉淀;
(3)桂醛的同分异构体符合下列条件:
a.苯环上连接着两个互为对位的基团,说明含有两个取代基且取代基在苯环上处于对位;
b.有一个甲基;
c.能与溴的四氯化碳溶液发生加成反应,说明含有碳碳不饱和键;
d.遇FeCl3溶液显示特征颜色,说明含有酚羟基;
(4)根据D一香芹酮的结构简式可知,D一香芹酮的不饱和度为4,M为芳香族化合物且与D一香芹酮互为同分异构体,则M中有苯环,其它键都为单键,所以A、B、C、D中都有苯环,D一香芹酮的分子式为C10H14O,所以M中有10碳原子,由B与丙醛反应生成C,结合题中已知信息可知,该过程为两个醛分子的加成,所以可以推知B中有7个碳原子,且B含有醛基,B是由A催化氧化得到的醛,则B为 、A为
、A为 ,进一步推得C为
,进一步推得C为 ,D能与2分子氢气加成,可推知D为
,D能与2分子氢气加成,可推知D为 ,所以M为
,所以M为 ,比较C和D的结构可知,C在浓硫酸加热的条件下脱去水,生成碳碳双键,得到D.
,比较C和D的结构可知,C在浓硫酸加热的条件下脱去水,生成碳碳双键,得到D.
解答 解:(1)桂醛中含有官能团为碳碳双键和醛基、玫瑰醇中官能团为碳碳双键和醇羟基、D-香芹酮中官能团为碳碳双键和羰基,所以这三种物质中都含有碳碳双键,
故答案为:碳碳双键;
(2)桂醛和玫瑰醇结构差别在于桂醛中含有醛基、玫瑰醇中含有醇羟基,醛能发生银镜反应或和新制氢氧化铜悬浊液发生氧化反应生成砖红色沉淀,所以可以用银氨溶液或新制氢氧化铜悬浊液鉴别桂醛和玫瑰醇,
故答案为:银氨溶液或新制氢氧化铜悬浊液;
(3)桂醛的同分异构体符合下列条件:
a.苯环上连接着两个互为对位的基团;
b.有一个甲基;
c.能与溴的四氯化碳溶液发生加成反应,说明含有碳碳不饱和键;
d.遇FeCl3溶液显示特征颜色,说明含有酚羟基,
符合这些条件的同分异构体为 ,
,
故答案为: ;
;
(4)根据D一香芹酮的结构简式可知,D一香芹酮的不饱和度为4,M为芳香族化合物且与D一香芹酮互为同分异构体,则M中有苯环,其它键都为单键,所以A、B、C、D中都有苯环,D一香芹酮的分子式为C10H14O,所以M中有10碳原子,由B与丙醛反应生成C,结合题中已知信息可知,该过程为两个醛分子的加成,所以可以推知B中有7个碳原子,且B含有醛基,B是由A催化氧化得到的醛,则B为 、A为
、A为 ,进一步推得C为
,进一步推得C为 ,D能与2分子氢气加成,可推知D为
,D能与2分子氢气加成,可推知D为 ,所以M为
,所以M为 ,比较C和D的结构可知,C在浓硫酸加热的条件下脱去水,生成碳碳双键,得到D;
,比较C和D的结构可知,C在浓硫酸加热的条件下脱去水,生成碳碳双键,得到D;
①根据上面的分析可知,试剂X为浓硫酸,故答案为:浓硫酸;
②M的结构简式为 ,故答案为:
,故答案为: ;
;
③D发生加聚反应的化学方程式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,正确推断物质结构简式是解本题关键,涉及同分异构体结构简式确定、物质推断、物质鉴别、官能团名称判断等知识点,利用物质性质差异性鉴别物质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中的七大基本物理量之一 | |
| B. | 1 mol任何物质都约含有6.02×1023个原子 | |
| C. | 以克为单位时,2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 | |
| D. | 在同温同压下,气体所占的体积主要由气体分子的物质的量决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) c(CH3COO-)c(CH3COOH) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑦ | C. | ①⑥⑦ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

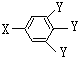
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+Cl2 (g)=2HCl(g)的反应热△H=2×E3-(E1+E2) | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)=2CO2(g)△H=(2a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com