
(14分)(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol?L-1,c(N)=2.4 mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2 mol?L-1,a = mol?L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为 。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。
 |
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:2012-2013学年安徽省宿松县复兴中学高二第二次月考化学试卷(带解析) 题型:填空题
(14分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是________________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)________0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________mol/L;c(OH-)-c(HA)=________mol/L。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
(5)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列________(填序号)。
查看答案和解析>>
科目:高中化学 来源:2013届山东省济宁市泗水一中高三上学期期末模拟化学试卷(带解析) 题型:填空题
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三上学期期末模拟化学试卷(解析版) 题型:填空题
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
(2)下列反应中属于取代反应的是 。(填序号)
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年海南琼海嘉积中学高三上学期高中教学质量监测(三)化学试卷(解析版) 题型:填空题
(12分)
(1)已知H2A在水中存在以下电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答问题:
H++A2-。回答问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性”或“无法确定”),
②某温度下,向0.1mol·L-1的NaHA溶液中滴入0.1mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是 (填字母)。
A.c(H+)· c(OH-) =1×10-14
B.c(Na+)+c(K+)=2c(A2-)+c(HA-)
C.c(Na+)=0.05mol ·L-1
D.c(Na+)= c(A2-)+c(HA-) +c(H2A)
(2)已知常温下:CaA(s) Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ksp=c(Ca2+)·c(A2—)。试回答:
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)
②滴加少量浓盐酸,c(Ca2+) ,原因是
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省上饶市高三第一次月考化学试卷(解析版) 题型:填空题
(本题共14分)5—氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:
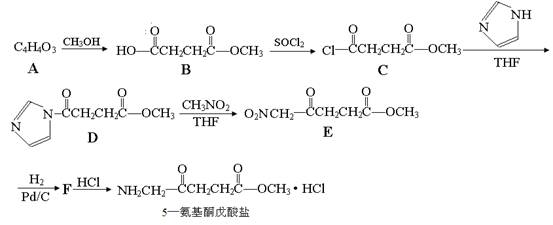
已知: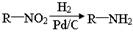
(1)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一个峰,则A的结构简式为 。
(2)5—氨基酮戊酸盐中含氧官能团的名称是 ,C→D的反应类型为 。
(3)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式 。
(4)写出D→E的反应方程式 。
(5)已知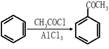 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、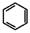 为原料合成
为原料合成 单体的合成路线流程图(无机试剂任选)。
单体的合成路线流程图(无机试剂任选)。
合成路线流程图示例如下: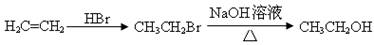
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com