
含下列键型的物质,可能为单质的是( ).
A.只有离子键的物质
B.既有离子键,又有非极性键的物质
C.既有极性键,又有离子键的物质
D.只有非极性键的物质
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:选择题
在一定温度下的定容密闭容器中,发生反应:A(g)+2B(g)  3C(g)。当下列物理量不再变化时,不能表明反应已达平衡的是 ( )
3C(g)。当下列物理量不再变化时,不能表明反应已达平衡的是 ( )
A.混合气体的压强 B.A的浓度不再变化 C.正逆反应速率相等 D.C的质量不再变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:选择题
关于下图所示装置的叙述,正确的是( )
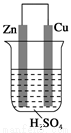
A.铜极质量逐渐减少
B.锌是正极,发生氧化反应
C.电流从锌片经导线流向铜片
D.阳离子向铜极移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:选择题
我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的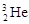 ,每百吨
,每百吨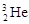 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以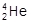 的形式存在。下列说法正确的是( )
的形式存在。下列说法正确的是( )
A. 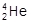 原子核内含有4个质子
原子核内含有4个质子
B. 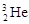 和
和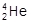 互为同位素
互为同位素
C. 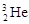 原子核内含有3个中子
原子核内含有3个中子
D. 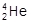 最外层电子数为2,所以
最外层电子数为2,所以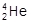 具有较强的金属性
具有较强的金属性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高二下学期期中化学试卷(解析版) 题型:填空题
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把1 mol N2与3 mol H2置于体积为1L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为1/3,则该温度下反应的K的计算式=________(用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
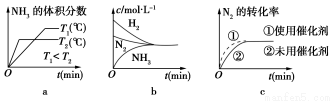
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:填空题
卤族元素的单质和化合物很多我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的________区;溴的价电子排布式为________;
(2)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
| 氟 | 氯 | 溴 | 碘 | 铍 |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(3)已知高碘酸有两种形式,化学式分别为H5IO6(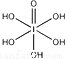 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6________ HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6________ HIO4.(填“>”、“<”或“=”)
(4) 与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列________式发生.
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,氯原子的杂化轨道类型为________,与ClO2-互为等电子体的微粒是________。(任写一个)
(6)下图为碘晶体晶胞结构.有关说法中正确的是________
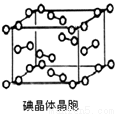
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
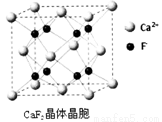
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期末化学试卷(解析版) 题型:选择题
在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。化学方程式分别为P4(s)+5O2(g)===P4O10(s);
4P(s)+5O2(g)===P4O10(s)。由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com