
科目:高中化学 来源: 题型:填空题
 ,其空间结构为正四面体;乙烯的结构简式为CH2=CH2,乙烯通入溴水中的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,,其反应类型为加成反应,C5H12的烃有3种同分异构体
,其空间结构为正四面体;乙烯的结构简式为CH2=CH2,乙烯通入溴水中的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,,其反应类型为加成反应,C5H12的烃有3种同分异构体查看答案和解析>>
科目:高中化学 来源: 题型:解答题
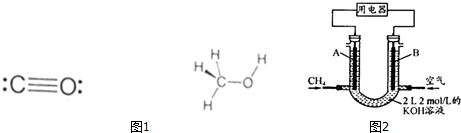
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×l05Pa,46gNO2中含有的分子数等于NA | |
| B. | 7.8gNa2O2含有的阴离子数目为0.2NA | |
| C. | 2.0g重水(D2O)中含有的质子数和中子数均为NA | |
| D. | 标况下,1.12LC12溶于水,转移0.05NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g | B. | 32g/mol | C. | 64 mol | D. | 64g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 金属元素与非金属元素间一定形成离子键 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将米饭在嘴中多加咀嚼就会变甜 | |
| B. | 羊毛和棉花的主要成分都是纤维素 | |
| C. | 为提高加酶洗衣粉的去污能力,应使用热水进行洗涤 | |
| D. | 未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室可用Na2SO3与浓H2SO4反应制备SO2 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | Na2SO3长期放置空气中容易变质 | |
| D. | SO2通入BaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.
材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com