
【题目】用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是
A.使用分液漏斗前要先检漏
B.碘在四氯化碳中的溶解度比在水中的溶解度小
C.碘的四氯化碳溶液在下层
D.分液时,碘的四氯化碳溶液从分液漏斗下口流出,水层从分液漏斗上口倒出
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】按以下装置图进行实验,填写有关现象及化学方程式。

(1)A中现象是____________________,
(2)B中浓硫酸的作用是_______________
(3)C中发生反应的化学方程式为______________,
(4)D中现象是_______________;反应的离子方程式是__________________________,
E中收集的气体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体中可能合有Na+、K+、NH4+、Fe2+、Fe3+、 Cl-、SO42-、CO32-、HCO3-,将其配成100mL溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:

请回答下列问题:
(1)配制100mL该溶液的过程中,“定容”操作正确的是________________。
A.  B.
B.  C.
C.  D.
D.
通过鉴定,该固体中一定存在的阳离子是_____________,一定不存在的阴离子是_____________。可能存在的离子是______________。实验过程生成气体的反应离子方程式为___________________
(2)下列实验结论符合事实的是_____________。
A.该固体中可能含有(NH4)2SO4、K2SO4、NaCl
B.该固体中可能含有(NH4)2SO4、KCl,一定不含NH4Cl
C.该固体中一定含有NH4Cl、K2SO4
D.该固体中可能含有(NH4)2SO4、KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
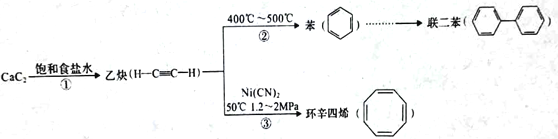
(1)反应①类似盐的水解,写出CaC2的电子式_________。
(2)苯是由哪位科学家首先发现的________,苯分子中有三个氢原子被-Br、-Br、-OH取代得到的芳香族化合物有_____种。将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,则此有机物的相对分子质量为________。
(3)写出反应③的化学反应方程式并注明反应类型__________。
(4)联二苯的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:

(1)实验室制备氨气的化学方程式为__________。
(2)用装置B收集氨气时,应选择氨气的进气口是_____(选填“a”或“b”),并说明选择的理由是___________。
(3)打开装置B中的止水夹c,若观察到圆底烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________,_________。
(4)为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_____(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。回答下列问题:

(1)写出各物质的化学式:A.___,B.___,C.____,D.____,E.____。
(2)写出B→C、D→E反应的离子方程式:
B→C:____________________________________________________________;
D→E:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,下列关于这四种元素及其化合物的说法中正确的是
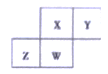
A. 单质X与单质Y、单质W的晶体类型都相同
B. 气态氢化物的稳定性:Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,正确的是 ( )
A. 把pH试纸浸入待测溶液中,测定溶液的pH
B. 称NaOH固体质量时,将NaOH固体放在垫有滤纸的托盘上进行称量
C. 苯酚沾在皮肤上,应立即用酒精清洗
D. 浓硫酸溅在皮肤上,应立即用烧碱溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是______.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______.
(5)在空气中加热5.49g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210℃时,固体质量减轻的原因是______.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com