
【题目】实验室拟将适量浓硝酸分多次加入铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
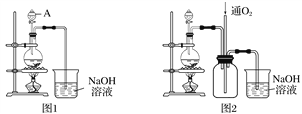
(1)图1烧瓶中随着反应分进行,可能发生反应的离子方程式为①____________________;
②_______________________________________。
(2)图2是图1的改进装置,其优点有:①_______________________________________;
②________________________________________________________________________。
(3)为符合绿色化学的要求,进行如下设计:
方案1:以空气为氧化剂,将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将3.2g铜丝放入45mL1.5mol·L-1的稀硫酸中,控温在50℃。加入18g10%的H2O2溶液,反应0.5小时后,升温到60℃,持续反应1小时后,过滤、蒸发、结晶、减压抽滤后,用少量95%的酒精淋洗后晾干,得10.6gCuSO4·5H2O。请回答下列问题:
①方案1中仪器B的名称是________________。
②方案2中生成CuSO4·5H2O的产率是________(保留三位有效数字)。
③上述两种方案中,更符合绿色化学理念的是________(填“方案1” 或“方案2”),理由是:该方案的优点是__________________________________________________;
另一方案的缺点是_________________________________________________________。
【答案】 Cu+4H++2NO==Cu2++2NO2↑+2H2O 3Cu+8H++2NO==3Cu2++2NO↑+4H2O 防止倒吸 有害气体能被完全吸收 坩埚 84.8% 方案2 方案2所得产品纯度较高或说铜很难在空气中完全被氧化 方案1需要灼烧,消耗能源多
【解析】(1)烧瓶中发生Cu与稀硝酸的氧化还原反应,首先发生反应:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,当反应进行到一定程度后溶液变稀,这时发生反应:②3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O;(2)图2是图1的改进装置,其优点有:①防止倒吸,②有害气体能被完全吸收;(3)方案1中仪器B用于灼烧固体药品,其名称为坩埚;②方案2中生成CuSO4·5H2O的产率为: 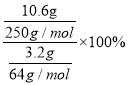 =84.8%;③上述两种方案中,更符合绿色化学理念的是方案2,理由是:方案2所得产品纯度较高或铜很难在空气中完全被氧化;方案1需要灼烧,消耗能源多。
=84.8%;③上述两种方案中,更符合绿色化学理念的是方案2,理由是:方案2所得产品纯度较高或铜很难在空气中完全被氧化;方案1需要灼烧,消耗能源多。


科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g)ΔH=+133kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:____________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
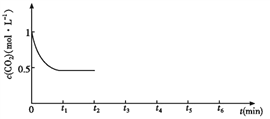
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。_____________
⑵改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______K(II)(填“﹥”“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”“逆向”或“不”)。
⑶利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,
装置如图所示:
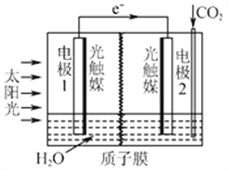
①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于治疗高血脂的新药灭脂灵(Hepronicate)是按如下路线合成的:
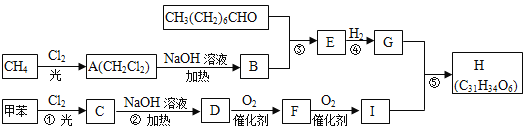
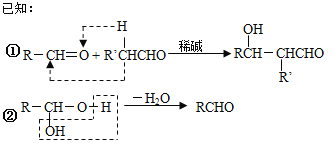
试回答:
(1)写出结构简式:E_________;E中所含官能团的名称是_______________________.
(2)上述①至⑤反应中属于取代反应的是_____________(填序号);
(3)写出反应方程式:
Ⅰ.反应②______________________________________________;
Ⅱ.反应⑤_______________________________________________;
Ⅲ.B与新制的Cu(OH)2悬浊液反应:____________________;
(4)分子式与I相同,属于芳香族化合物的同分异构体有_________种(不含其它的环不包括I)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 将w g a%的NaCl溶液蒸发掉![]() g水,得到2a%的NaCl溶液
g水,得到2a%的NaCl溶液
B. 将1Lc mol/L的硫酸溶液用4L水稀释,稀释后溶液的物质的量浓度等于0.2c mol/L
C. 标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为
![]()
D. 将1.6 g CuSO4·5H2O晶体溶于水配成1L溶液,制得0.01 mol/L的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 第二周期元素从C到F,非金属性逐渐减弱
B. 第三周期元素从Na到Cl,原子半径逐渐增大
C. HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D. LiOH、NaOH、KOH的碱性依次逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是
![]()
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D为NaOH,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D为H2SO4,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是

A. a,b,c三点溶液的pH:a>b>c
B. 若用湿润的pH试纸测试c处溶液的pH,比实际的pH偏小
C. a,b,c三点溶液用1mol·L-1的NaOH溶液中和,消耗NaOH溶液的体积a>b>c
D. a,b,c点醋酸的电离程度:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某淡黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂。根据下图所示转化关系及现象填空:
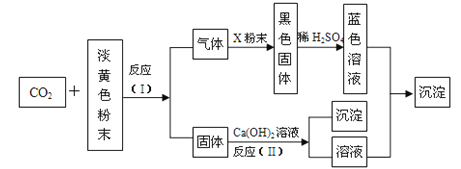
(1)该淡黄色粉末为__________________;
(2)X粉末的名称为__________________;
(3)反应(I)的化学方程式为______________________________;
(4)反应(II)的化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com