

| A. | n(Cl2)、n(HClO)和n(ClO-)之和不随pH变化而变化 | |
| B. | 当pH逐渐增大时,HClO先增大后减小 | |
| C. | 当pH>8.5时,c(H+)=c(OH-)+c(ClO-)+c(Cl-) | |
| D. | K1、K2均是通过曲线交点计算得出的酸的电离平衡常数 |
分析 A.氯水中存在电离平衡:Cl2+H2O?HClO+H++Cl-,HClO?H++ClO-,次氯酸为弱酸,电离受PH的影响;
B.当pH逐渐增大时,酸性减弱,碱性增强,氯气和水反应的平衡右移,HClO增大;
C.任何电解质溶液中都存在电荷守恒,所以任意PH时,溶液中电荷总是守恒;
D.Cl2(g)?Cl2(aq) K1a,Cl2(aq)+H2O?HClO+H++Cl- K2a,HClO?H++ClO- Ka=$\frac{C({H}^{+})C(Cl{O}^{-})}{C(HClO)}$.
解答 解:A.氯水中存在电离平衡:Cl2+H2O?HClO+H++Cl-,HClO?H++ClO-,氯水中存在Cl2、HClO、HCl,根据得失电子守恒n(Cl-)=n(HClO)+n(ClO-),2n(Cl2)=n(Cl-)+n(HClO)+n(ClO-),n(Cl2)+n(HClO)+n(ClO-)=n(Cl-)+n(Cl2),Cl2+H2O?HClO+H++Cl-,氯离子的增加量,等于氯气的减少量,n(Cl2)、n(HClO)和n(ClO-)之和不随pH变化而变化,故A正确;
B.PH=-lgC(H+),当pH逐渐增大时,酸性减弱,碱性增强,电离平衡:Cl2+H2O?HClO+H++Cl-,HClO?H++ClO-平衡右移,HClO增大,故B错误;
C.任意PH时,体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),而不是只有当pH>8.5时才成立,故C错误;
D.K1曲线交点,此时c(Cl2)=c(HClO),Cl2(aq)+H2O?HClO+H++Cl-,因氯离子浓度未知,无法求算K2a,K2曲线交点,此时c(HClO)=c(ClO-),HClO?H++ClO- Ka=$\frac{C({H}^{+})C(Cl{O}^{-})}{C(HClO)}$.根据交点的对应的PH即可求出次氯酸的电离平衡常数,因无法求算K2a,故D错误;
故选B.
点评 本题以氯水为载体考查了电离平衡常数的计算、离子浓度大小比较、物质的稳定性等知识点,正确分析图象中各个物理量的关系是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段表示电解水 | |
| D. | CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全燃烧生成二氧化碳和水的化合物不一定是烃 | |
| B. | 相同质量的正丁烷和异丁烷分别完全燃烧,耗氧量相等 | |
| C. | 相同物质的量乙烯和乙醇分别完全燃烧,耗氧量相等 | |
| D. | 相同质量的乙烷和乙炔分别完全燃烧,耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g${\;}_{6}^{14}$C中含有的质子数为14NA | |
| B. | 1mol苯乙酸中所含碳碳双键数为4NA | |
| C. | 1L 2mol/L的NaClO水溶液中含有的氧原子数为2NA | |
| D. | 标准状况下,3.36L NO2和足量水充分反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:实验题

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。 其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。

(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是_________
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
氧化还原反应与四种基本类型反应的关系如 图所示,则下列化学反应属于阴影部分的是
图所示,则下列化学反应属于阴影部分的是
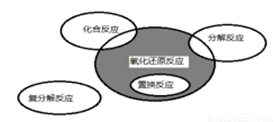
A. CuSO4+Mg=Cu+MgSO4
CuSO4+Mg=Cu+MgSO4
B.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.2Na2O2+2CO2=2Na2CO3+O2
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:计算题
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(1)若某可逆反应的化学平衡常数表达式为:K=C(CO)·C(H2)/C(H2O)
写出该反应的化学方程式:_____________________。
(2) CO(g)+H2O(g) CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状
CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状 态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中H2SO4的物质的量浓度为18.4mol/L.
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中H2SO4的物质的量浓度为18.4mol/L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com