
【题目】金、银、铜、铁、铝和钛均是人类生产和生活中大量使用的金属。试回答与上述金属原子结构有关的问题:
(1)上述金属元素中属于主族元素的有______。
(2)钛被称为继铁、铝之后的“第三金属”。基态钛原子外围电子排布图为______。
(3)基态金原子的外围电子排布式为![]() ,试判断金在元素周期表中位于第______周期第______族。
,试判断金在元素周期表中位于第______周期第______族。
(4)已知![]() 与
与![]() 位于同一族,则
位于同一族,则![]() 在元素周期表中位于______区。
在元素周期表中位于______区。
【答案】铝 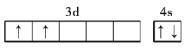 六 ⅠB ds
六 ⅠB ds
【解析】
(1)铝属于主族元素;
(2)钛基态原子核外电子排布式为1s22s22p63s23p63d24s2,其外围电子排布式为3d24s2;
(3)电子排布式中能层数与周期数相等,外围电子排布式为(n-1)d10ns1的原子位于第IB族;
(4)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区。
(1)铝位于第三周期第ⅢA族,属于主族元素,金、银、铜、铁、和钛都不属于主族元素;
(2)钛基态原子核外电子排布式为1s22s22p63s23p63d24s2,其外围电子排布式为3d24s2,则其外围电子的电子排布图为: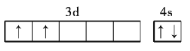 ;
;
(3)电子排布式中最大能层数与周期数相等,外围电子排布式为(n-1)d10ns1的原子位于第IB族,基态金原子的外围电子排布式为5d106s1,该原子最大能层数是6,所以金原子位于第6周期第ⅠB族;
(4)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区,Ag与Cu位于同一族,属于第ⅠB族,所以属于ds区。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知2SO2(g) + O2(g) ![]() 2SO3(g) + Q kJ(Q>0)。在10 L恒温恒容密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0. 025 Q kJ。下列判断正确的是
2SO3(g) + Q kJ(Q>0)。在10 L恒温恒容密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0. 025 Q kJ。下列判断正确的是
A.在2 min内,O2的转化率为25%
B.在1min时,c(SO2) + c(SO3) = 0.01 mol/L
C.若再充入0.1 mol SO3,达到平衡后SO3的质量分数会减小
D.向该容器中再加入0.1 mol SO2和0.05 mol O2,平衡后反应放热大于0.05Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
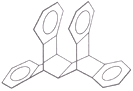
A.Janusene的分子式为C30H24
B.一定条件下1mol Janusene能与3mol氢气发生加成
C.Janusene苯环上的一氯代物有6种
D.Janusene既可发生氧化反应,也可发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A ( g)+B(g)![]() 2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
A.用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol · L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA
B.常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA
C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D.6.8g熔融态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18个纵行,下图实线表示元素周期表的边界。按核外电子排布,可把元素周期表里的元素划分为![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区等。除
区等。除![]() 区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
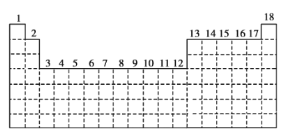
(1)请在上图中用实线画出![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区的边界线,并分别用阴影
区的边界线,并分别用阴影![]() 和
和![]() 表示
表示![]() 区和
区和![]() 区________。
区________。
(2)有的同学受这种划分的启发,认为![]() 区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
(3)请在上述元素周期表中用元素符号标出![]() 轨道处于半充满状态的元素________。
轨道处于半充满状态的元素________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10min时,平均反应速率υ(NO2) = ____________________ ,电子转移了 ___________ 个。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是____________。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2)正 = 7v(N2)逆
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_________ (填增大、不变、减小),NO2的转化率 ______________。
(4)一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
a.一定向正反应方向移动 b. 平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃A,其蒸气密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
(1)若A不是烯烃与氢气加成的产物,则A的结构简式为:__________________________;
(2)若A是炔烃与氢气加成的产物,则A的名称为:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com