
| A. | NaHS03溶液显酸性:HS03-═H++S032- | |
| B. | 苯酚钠溶液中通入少量C02: C6H50+CO2+H20→C6H50H+HCO3- | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2Fe042-+3Cl-+H20+4H+ | |
| D. | 向 Ca(Cl0)2 溶液中通入过量 S02:Ca2++2C10-+SO2═CaSO4↓+2Cl- |
分析 A.存在电离平衡;
B.反应生成苯酚和碳酸氢钠;
C.强碱溶液中不能生成氢离子;
D.发生氧化还原反应生成硫酸钙、盐酸.
解答 解:A.NaHS03溶液显酸性,发生电离方程式为HS03-?H++S032-,故A错误;
B.苯酚钠溶液中通入少量C02的离子反应为C6H50+CO2+H20→C6H50H+HCO3-,故B正确;
C.强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(OH)3═2Fe042-+3Cl-+5H20,故C错误;
D.向 Ca(Cl0)2 溶液中通入过量 S02的离子方程式为:2ClO-+Ca2++2H2O+2SO2=2Cl-+CaSO4↓+4H++SO42-,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应及分析与应用能力的考查,注意保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 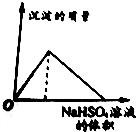 | B. | 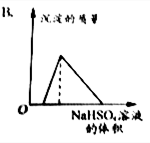 | ||
| C. |  | D. | 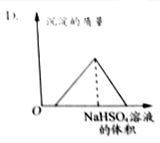 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
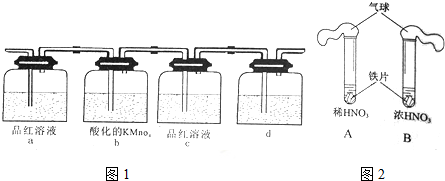
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
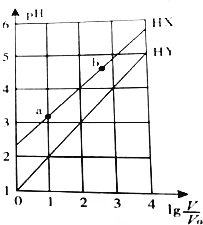
| A. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | 常温下,由水电离出的c(H+)•c(OH-):a<b | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加热条件下能使不活泼金属铜溶解,表现出浓硫酸的强氧化性和酸性 | |
| B. | 可以用铁制或铝制容器贮运,表现出浓硫酸有稳定的化学性质 | |
| C. | 能使胆矾晶体由蓝色变为白色,表现出浓硫酸的脱水性 | |
| D. | 能使蔗糖炭化,表现出浓硫酸的吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; | 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com