
| A. | 自来水 | B. | 0.5 mol/L盐酸 | C. | 0.5mol/L 氨水 | D. | 0.5 mol/LNaNO3 |
分析 电解质溶液导电性强弱与离子浓度成正比,与电荷成正比,如果把0.05molNaOH固体分别加入到100ml下列液体中,溶液导电能力变化最小,反应加入NaOH固体前后离子浓度变化最小,据此分析解答.
解答 解:电解质溶液导电性强弱与离子浓度成正比,与电荷成正比,如果把0.05molNaOH固体分别加入到100ml下列液体中,溶液导电能力变化最小,反应加入NaOH固体前后离子浓度变化最小,
A.加入到自来水中,水中离子浓度很小,加入NaOH后溶液中离子浓度变化较大,则溶液导电能力变化较大,故A不选;
B.加入到0.5mol/L的稀盐酸中,二者恰好完全反应生成强电解质NaCl,HCl、NaCl都是强电解质,在加入NaOH固体前后离子浓度变化不大,则溶液导电能力变化不大,故B选;
C.0.5mol/L 氨水,一水合氨是弱电解质,在溶液中部分电离,离子浓度较小,溶液导电性较弱,加入NaOH固体后,离子浓度变化较大,则溶液导电能力变化较大,故C不选;
D.NaNO3是强电解质,加入NaOH后,二者不反应,但溶液中离子浓度增大一倍,则溶液导电能力增大一倍,溶液导电能力变化较大,故D不选;
故选B.
点评 本题以溶液导电能力强弱为载体考查离子反应,侧重考查学生分析判断能力,明确溶液导电性强弱影响因素及物质之间的反应是解本题关键,注意:溶液导电性强弱与电解质强弱及物质溶解性强弱都无关,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 甲 | 乙 | 丙 | 戊 | |
| A | Cu | FeCl3溶液 | CuCl2溶液 | Fe |
| B | H2O | Fe | H2 | O2 |
| C | CH3CH2OH | O2 | CH3CHO | H2 |
| D | SiO2 | Na2CO3 | Si | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
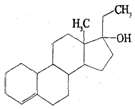 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述错误的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述错误的是( )| A. | 分子式为C20H30O | |
| B. | 能使溴的四氯化碳溶液褪色 | |
| C. | 能发生加成、取代、氧化反应 | |
| D. | 在浓硫酸作用下,分子内脱去一个水分子,产物有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L 水所含分子数目为 NA | |
| B. | 1mol•L-1K2SO4溶液所含 K+数目为 2NA | |
| C. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| D. | O2 的摩尔体积约为 22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+CO2↑+H2O | B. | CuO+2HCl=CuCl2+H2O | ||
| C. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | D. | NaOH+HCl=NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51.2% | B. | 36% | C. | 22% | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com