
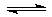
 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A.t1时,只有正向反应 | B.t2时反应达到限度 |
| C.t2-t3时,反应停止 | D.t2-t3时,v(Y2)=v(Z) |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:不详 题型:填空题
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3溶液 | |
| ③ | ______ | ______ | ______ | |
| ④ | ______ | ______ | ______ |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol/(L?min)) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.全部 | B.(2)(3) | C.(4) | D.(2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.保持容器容积不变,向其中加入1molH2,化学反应速率不变 |
| B.保持容器容积不变,向其中加入1molAr,化学反应速率增大 |
| C.保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变 |
| D.保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),新平衡时化学反应速率不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H<0,m+n<p | B.△H>0,m+n>p | C.△H<0,m+n>p | D.△H>0,m+n<p |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A、B、C是气体,D不是气体 |
| B.A、B是气体,C、D有一种是气体 |
| C.C、D是气体,A、B有一种是气体 |
| D.C、D有一种是气体,A、B都不是气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
| D.实验室用排饱和食盐水而不用排水法收集氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com