
| A. | ①=③>②>④ | B. | ①>②>④>③ | C. | ③>①=②>④ | D. | ④>③>②>① |
分析 ①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;
③氢氧化钠与二氧化碳反应生成碳酸钠;
④亚硫酸钠和氧气反应生成硫酸钠.
解答 解:①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;Na2O~Na2CO3;1molNa2O反应最后增加1molCO2的质量为 44g;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;Na2O2~Na2CO3,1molNa2O2反应最后增加1molCO的质量为28g;
③氢氧化钠与二氧化碳反应生成碳酸钠;NaOH~$\frac{1}{2}$Na2CO3,1molNaOH反应最后增重53-40=13g;
④亚硫酸钠和氧气反应生成硫酸钠;Na2SO3~Na2SO4,1molNa2SO3反应后增重16g;
故增重为①>②>④>③.
故选B.
点评 本题考查钠及其化合物性质的应用,为高频考点,侧重考查学生的分析能力,明确变化过程中的质量变化计算是解答本题的关键,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. |  用如图装置电解精炼镁 | |
| B. |  用如图装置验证试管中铁丝发生析氢腐蚀 | |
| C. |  如图装置中Mg作负极,Al作正极 | |
| D. |  用如图装置对二次电池进行充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒2-3次,洗液倒入烧杯中 | |
| C. | 称量11.7 g NaCl配制0.2 mol/L NaCl溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W | Q |
| 原子半径(nm) | 0.073 | 0.077 | 0.099 | 0.102 | 0.118 |
| 主要化合价 | -2 | +4、-4 | -1 | +6、-2 | +3 |
| A. | 单质沸点:W>Q>Z | |
| B. | W与Q形成的常见化合物可以稳定存在于水溶液中 | |
| C. | Z的含氧酸的酸性大于W的含氧酸的酸性 | |
| D. | X、Y、W三种元素两两之间均能以共价键形成AB2型的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
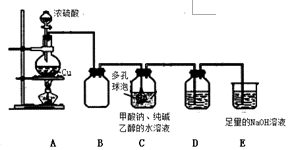 已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:
已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:| 假设 | 操作 | 现象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中, 滴加紫色水蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S为+3 价,具有较强 的还原性. | 取少量溶液于试管中, 滴加过量新制氯水,再 滴加 BaCl2 溶 | 有白色沉淀生 成 | 该反应的离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ ,Ba2++SO42-=BaSO4↓; |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24LH2O含有的分子数等于0.1NA | |
| B. | 1.12LO2和1.12LN2所含原子数一定相等 | |
| C. | 分子数为NA的CO气体质量为28克 | |
| D. | 500mL2mol/L的氯化钙溶液中Cl数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大多数合金的熔点比它的各成分金属的高 | |
| B. | 生铁和钢都是铁的合金,生铁的含碳量低于钢 | |
| C. | 日常生活中使用更多的是纯金属而不是合金 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com